临床研究人员目前正在重新调整小分子抗病毒和抗炎药的用途,以治疗SARS-CoV-2引起的新型冠状病毒病(COVID-19)。研究阶段通常需要进行剂量研究,而药代动力学(PK)和药效学(PD)是该过程的关键组成部分。针对这些候选药物,需要采用探索性的检测方法来协助完成此项工作。LC-MS/MS作为一种定量分析方法,能够通过单次运行完成多种药物的测定并缩短周转时间,符合上述需求。
本研究开发了一种使用50 µL样品分析血浆中法匹拉韦、瑞德西韦(GS-5734)、GS-441524、氯喹、羟氯喹、脱乙基氯喹、洛皮那韦、利托那韦和地塞米松的方法。使用含内标的溶液沉淀样品,然后稀释上清液,再进样至ACQUITY UPLC I-Class/Xevo TQ-S micro IVD系统。分离采用CORTECS T3, 2.1 mm x 50 mm, 2.7 µm色谱柱以梯度洗脱方式进行,所用流动相由甲酸铵、甲酸和甲醇组成。
结果表明,该方法能够发挥出色的分析灵敏度、线性、精密度和准确度,而且在相关分析物范围内具有可重现的提取效率和基质效应。本研究评估了样品在血浆中的稳定性,并推断应限制样品暴露于室温下,以尽量减少含瑞德西韦样品的降解。
在临床研究中,该方法为能够测定小分子抗病毒和抗炎药的分析方法提供了一个良好的开端。
为快速应对新型冠状病毒病(COVID-19)疫情,研究人员正在对各种抗病毒和抗炎药进行临床研究试验,以期通过阻碍病毒融合和复制以及后续的过度刺激炎症反应来减少SARS-CoV-2病毒的影响。对于这些重新调整用途的药物,由于尚未完全掌握一些新型抗病毒药物的药代动力学和药效学作用,因此确定其正确给药方案就变得尤其重要。
为全力支持与这些调查相关的研究,需要使用合适的分析方法以提供精准数据。LC-MS/MS作为一种定量分析方法,能够通过单次运行完成多种药物的测定并缩短周转时间,符合上述需求。
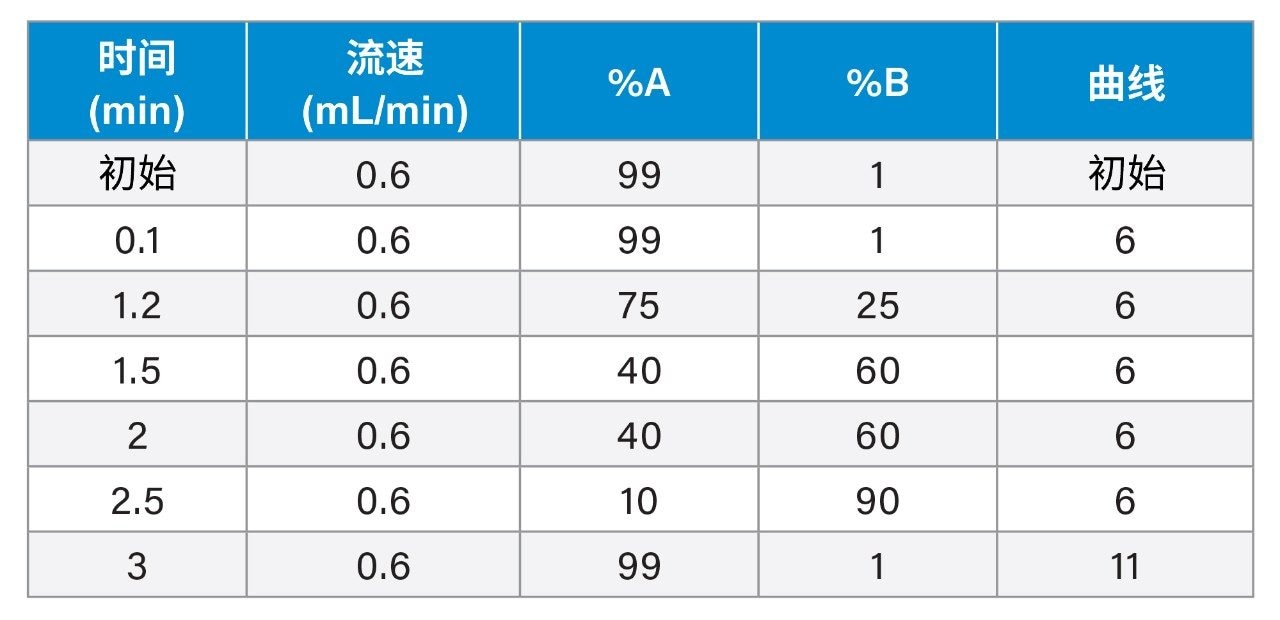
本研究开发了一种在临床研究中分析血浆中法匹拉韦、瑞德西韦(GS-5734)、GS-441524、氯喹、羟氯喹、脱乙基氯喹、洛皮那韦、利托那韦和地塞米松的LC-MS/MS方法。该方法先进行简单的蛋白沉淀,然后进样至ACQUITY UPLC I-Class PLUS系统,并使用Xevo TQ-S micro质谱仪进行检测。该方法使用CORTECS 2.7 µm色谱柱快速分离化合物(进样间运行时间为4 min,图1),并且在剂量递增研究期间,Xevo TQ-S micro系统的宽动态范围为这些化合物的分析提供了灵活性。
使用100 µL含内标的30/70 (v/v)甲醇/0.1M ZnSO4(水溶液)沉淀50 μL血浆。充分混合,然后在4000 g离心力下离心5 min。先用100 µL流动相A稀释50 µL上清液,再进样。
|
LC系统: |
ACQUITY UPLC I-ClassFL |
|
色谱柱: |
CORTECS T3, 2.1 mm x 50 mm, 2.7 µm |
|
柱温: |
45 °C |
|
样品温度: |
8 °C |
|
进样体积: |
15 µL |
|
流动相A: |
含10 mM甲酸铵和0.2%甲酸的水溶液 |
|
流动相B: |
甲醇 |
|
运行时间: |
3.3 min |
|
MS系统: |
Xevo TQ-S micro |
|
电离模式: |
ESI+ |
|
采集模式: |
MRM(多反应监测) 详细参数见表格 |
|
毛细管电压: |
0.50 kV |
|
离子源温度: |
150 °C |
|
脱溶剂气温度: |
500 °C |
|
锥孔气流速: |
125 L/h |
|
脱溶剂气流速: |
1000 L/h |
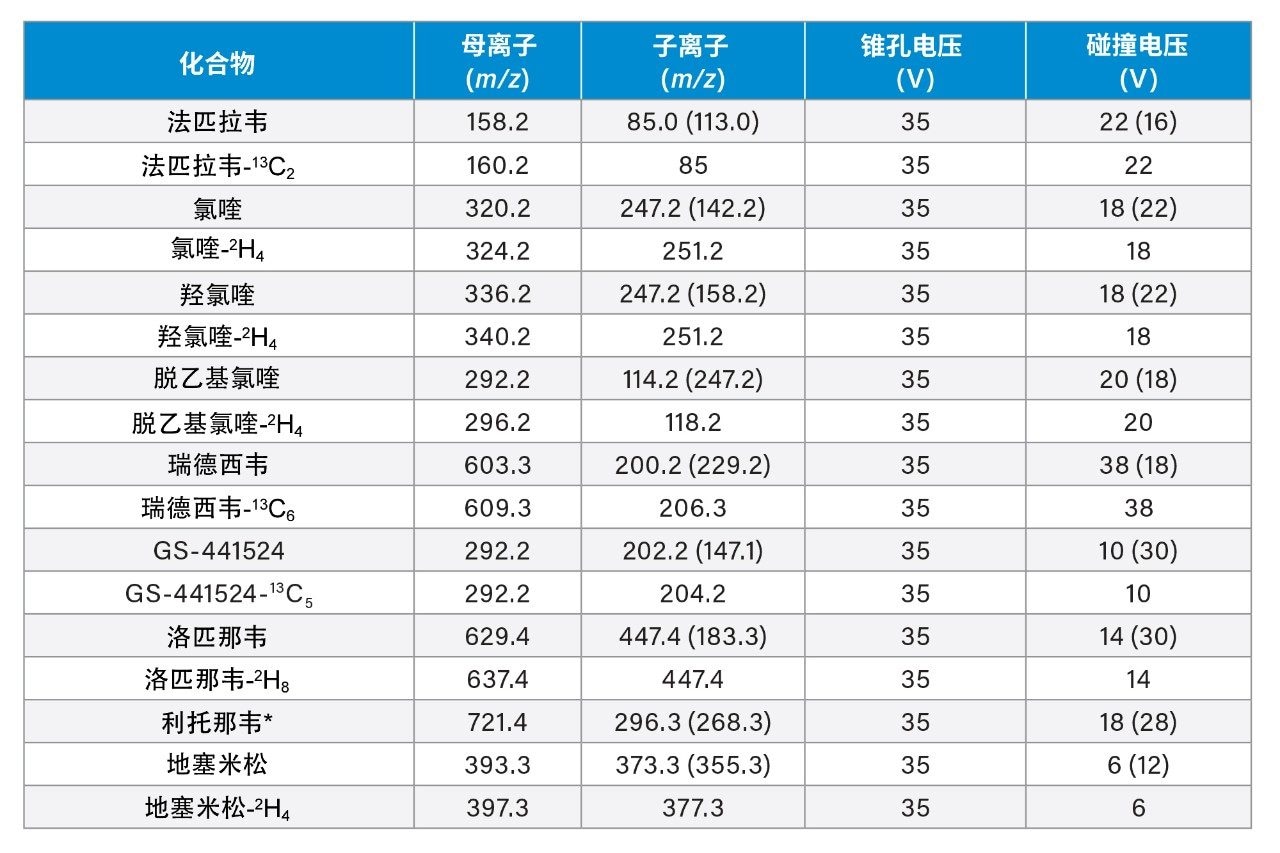
定性离子参数见括号内。(*利托那韦使用洛匹那韦-2H8 作为内标,原因是在方法开发期间使用利托那韦13C3作为标记物时,观察到高浓度利托那韦产生了影响线性的干扰。)
|
MS软件: |
MassLynx软件4.2版自带的TargetLynx XS应用管理软件 |
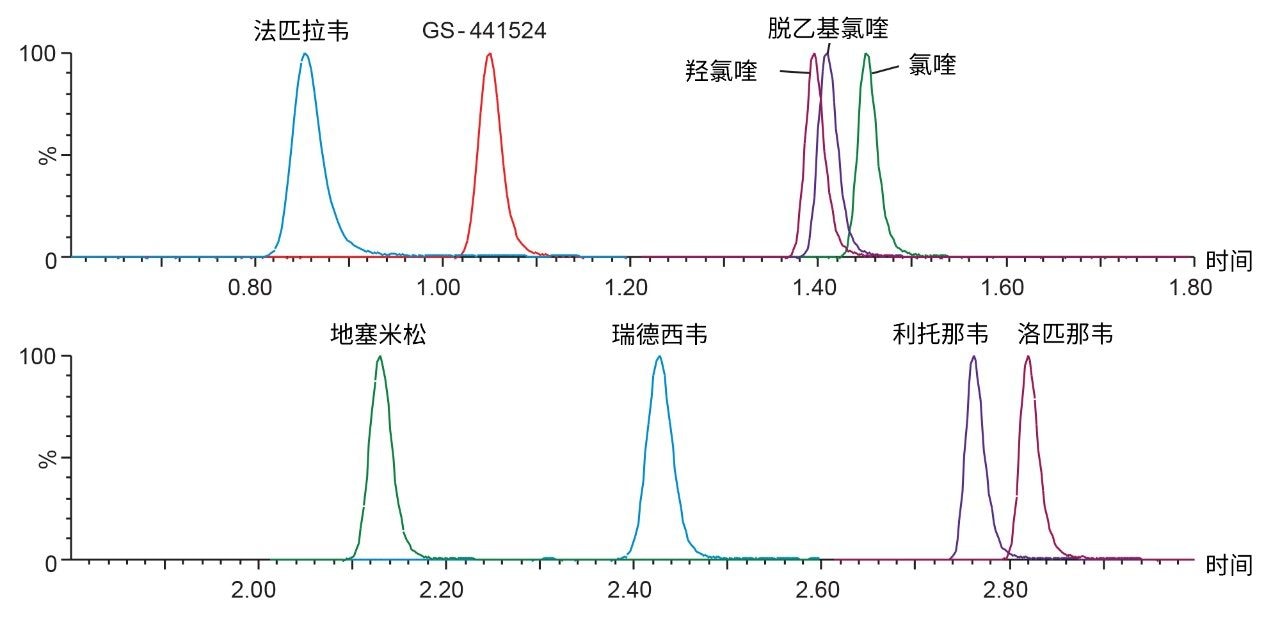
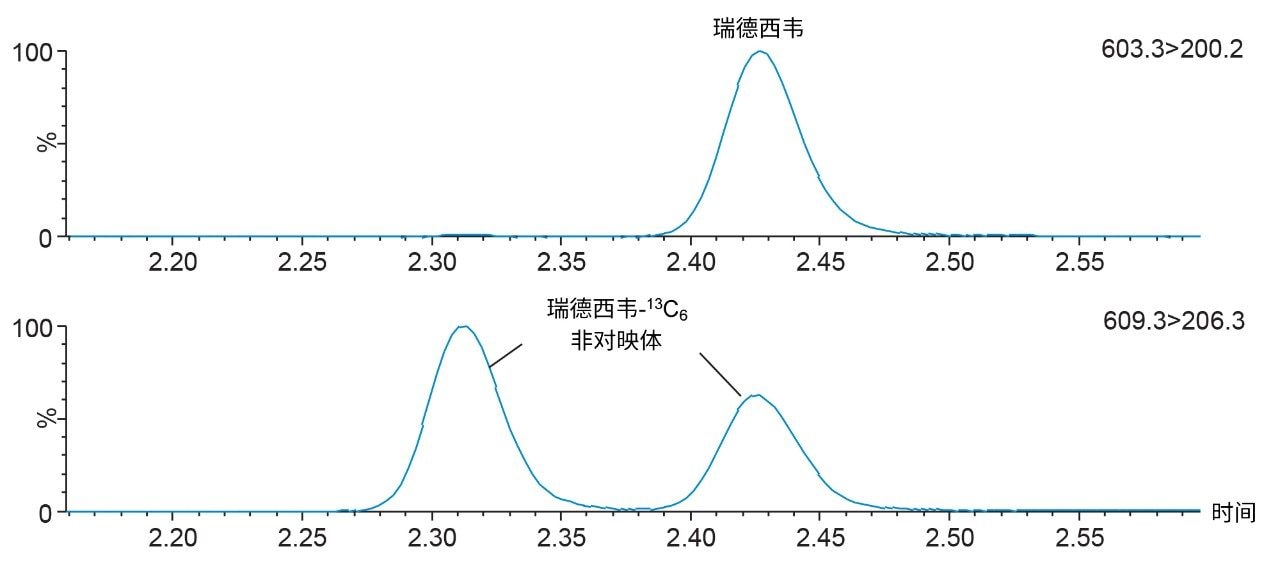
根据FDA 2018版《生物分析方法验证行业指南》(Bioanalytical Method Validation Guidance for Industry)评价所开发的方法1。 色谱分离采用CORTECS T3, 2.1 mm x 50 mm, 2.7 µm色谱柱。此方法使用的梯度条件能够保留极性分析物,例如法匹拉韦(0.85 min)和GS-441524(1.05 min),同时对非极性化合物,例如利托那韦(2.76 min)和洛匹那韦(2.82 min)具有色谱选择性,还能分离瑞德西韦-13C6非对映异构体内标(用于准确定量瑞德西韦)(图2)。
结果表明,该方法用于所有分析物时,5次独立运行的校准曲线(1/x权重)均呈线性,r2均> 0.995,证明该方法能够在宽动态范围内分析这些化合物(表1)。低浓度校准品的信噪比(S/N)评估结果证明了该方法对这些分析物的分析灵敏度。结果表明,这些低浓度校准品的S/N在5次独立运行中均大于25:1。
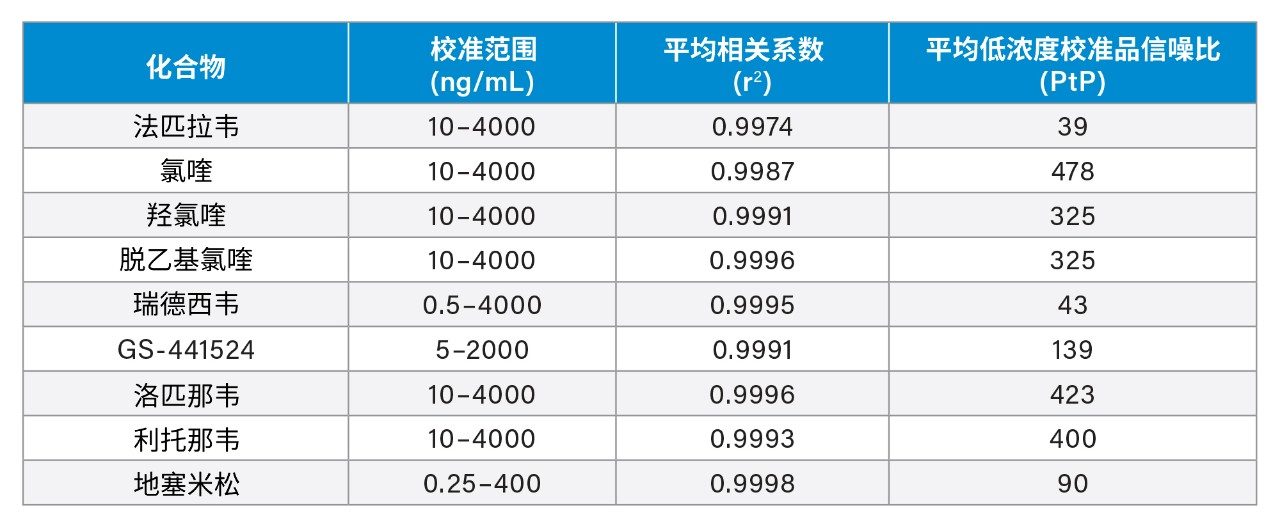
我们在五天内每天对三个浓度的QC样品进行提取和定量分析,每个浓度五个重复样(n = 30),确定方法的总精密度。每个QC水平设置五个重复样,以评估方法的重复性。法匹拉韦、氯喹、羟氯喹、脱乙基氯喹、洛匹那韦和利托那韦的低、中、高浓度分别为40、400、3000 ng/mL;瑞德西韦的分别为2、400、3000 ng/mL;GS-441524的分别为20、200和1500 ng/mL;地塞米松的分别为1、20和200 ng/mL。QC准确度范围为94%~108%,所有分析物三种浓度下的总精密度和重复性均≤ 9.1%(图3)。
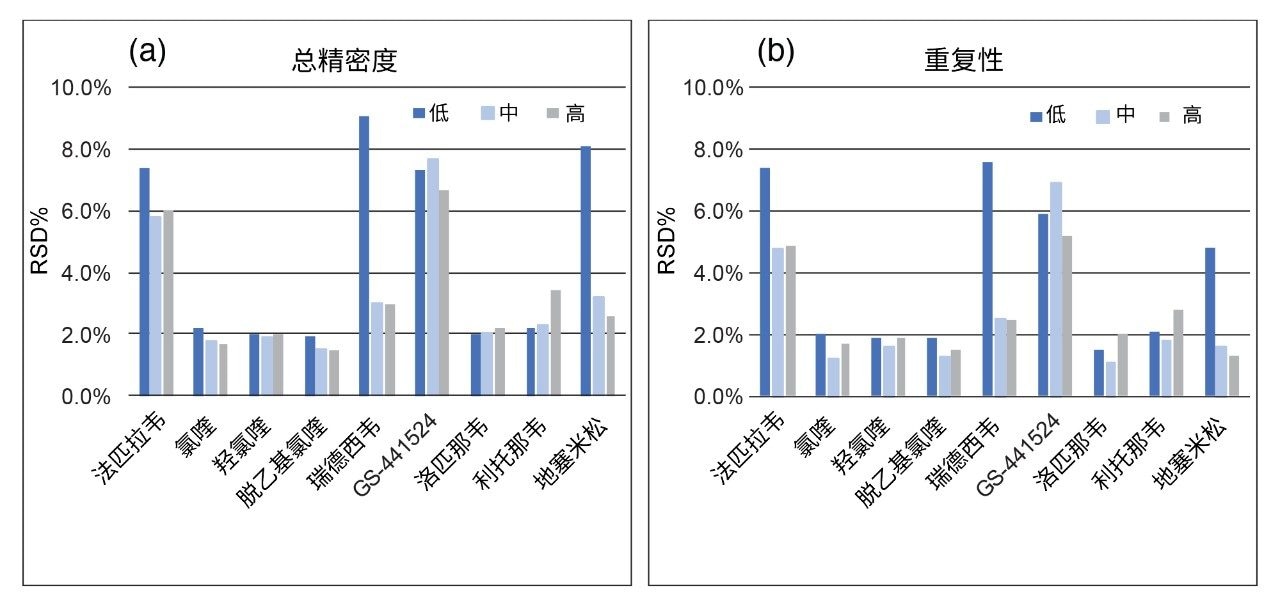
由于之前已确定室温下瑞德西韦在血浆中不稳定2,因此本研究评价了血浆样品中分析物在室温和冻融条件下的稳定性,以掌握分析物不稳定性在样品储存和前处理过程中的影响。低浓度和高浓度下2 h和4 h的平均室温稳定性以及3次冻融的稳定性见表2。
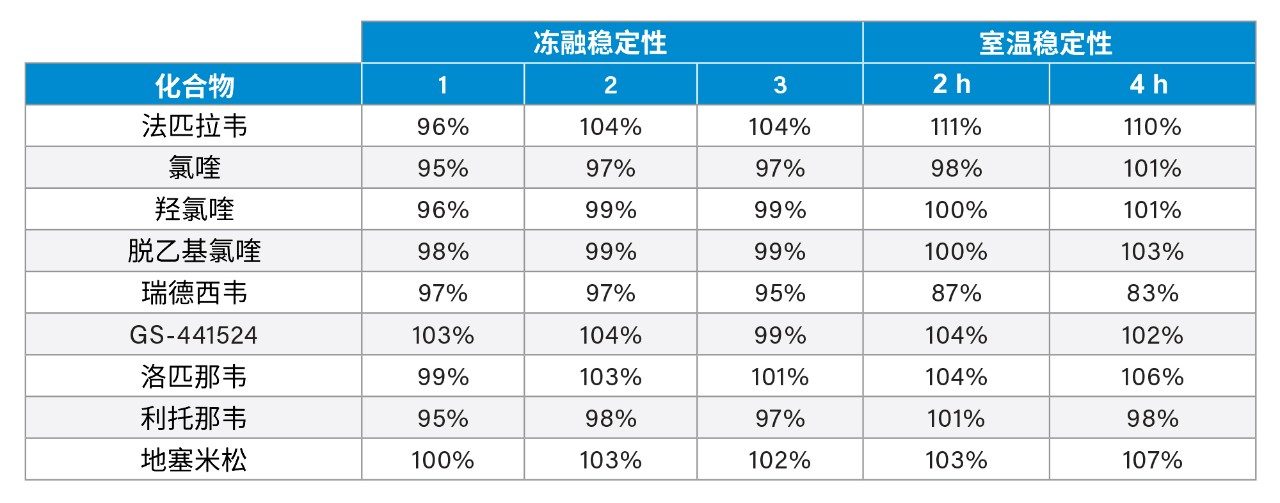
结果表明,应尽可能减少含瑞德西韦样品暴露于室温下的情况,样品在3次冻融评估期间保持稳定。此外,还研究了提取样品上样到自动进样器后的稳定性,结果表明样品可在8℃下稳定储存124 h。
使用单个血浆供体样品(BioIVT,n = 6)进行了分析物的基质效应研究。基质因子计算结果见图4。基于分析物:内标响应比率计算归一化的基质因子,结果表明内标可以补偿观察到的所有离子抑制效应,并且该结果在单个样品中可重现。
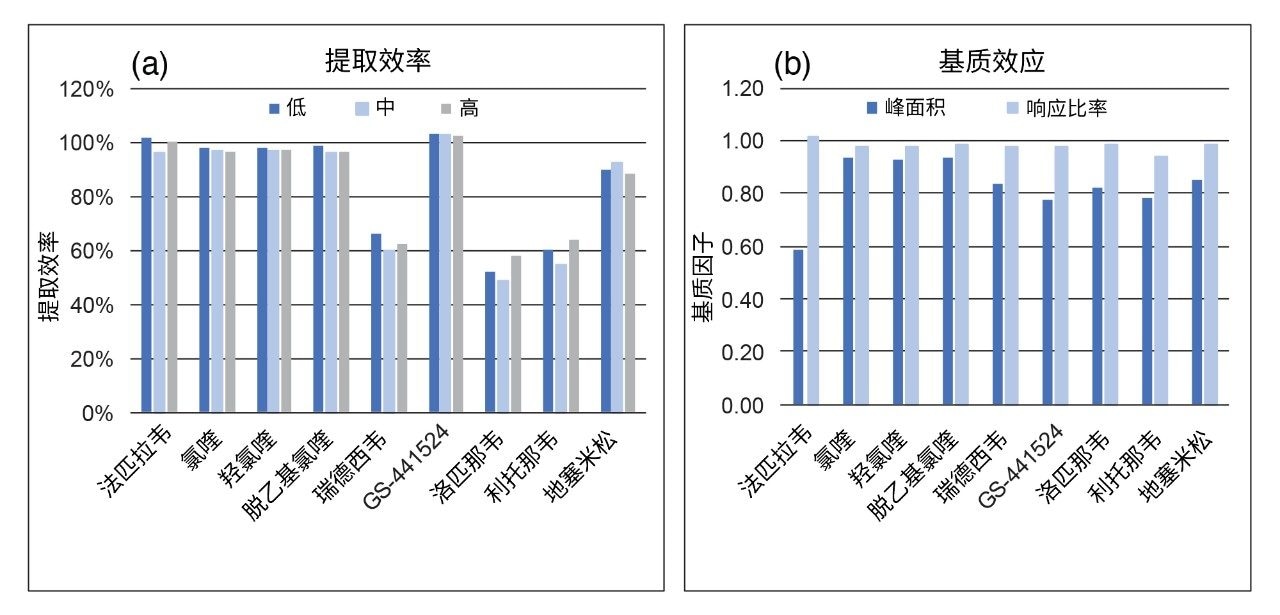
提取效率的评价方法是在三种浓度下评估提取的血浆样品,然后将其与后加标的空白血浆样品进行比较。结果表明,每种分析物在不同浓度下的提取效率均可重现,而非极性化合物的回收率较低(图3b)。
本研究利用ACQUITY UPLC I-Class/Xevo TQ-S micro IVD系统开发了一种简单、快速的LC-MS/MS方法,用于在临床研究中分析血浆中的抗病毒和抗炎药。
该方法采用简单的蛋白沉淀法从血浆中提取药物,然后使用CORTECS T3色谱柱进行色谱分析,以便有选择性并且快速地从提取样品中分离出药物。分析灵敏度、线性、精密度和准确度非常出色,提取效率和基质效应亦可重现。
关于这些药物及其代谢物对SARS-CoV-2治疗效果的临床研究仍在进行中。目前我们尚未对RNA聚合酶抑制剂的磷酸化代谢物进行评估,而核苷三磷酸化瑞德西韦是外周血单核细胞(PBMC)中的主要代谢物,这可能成为另一个研究热点3。 由于磷酸化分子能够与金属结合,因此使用LC-MS/MS方法实现稳定、可重现的定量分析是一道棘手难题。未来在研究LC-MS/MS法对磷酸化分子进行可靠定量分析的方法时,可以使用螯合剂添加剂或高性能表面(HPS)技术弥补现有不足。
720006987ZH,2020年8月