
仅供研究使用,不适用于诊断。
COVID-19疫情的爆发推动业界进一步开发LC-MS方法用于检测病毒感染,使其能够作为当前感染检测技术的补充手段。有研究者建议,将靶向质谱分析用于检测蛋白酶解后体液中的病毒蛋白,作为额外的SARS-CoV-2检测方法。本文所述研究展示了UniSpray和电喷雾电离源在Xevo TQ-XS串联四极杆质谱仪检测所选SARS-CoV-2胰蛋白酶肽中的应用。
COVID-19冠状病毒病是由SARS-CoV-2引起的高致病性病毒感染,是造成当前疫情持续大流行的根源。SARS-CoV-2病毒颗粒富含蛋白质,包含突刺糖蛋白(SPIKE)与核蛋白(NCAP)两种主要成分。研究人员考虑将靶向LC-MS法用于SARS-CoV-2蛋白的检测和定量,作为COVID-19病毒载量测定的替代技术,以补充聚合酶链式反应(PCR)检测方法1,2。因此,业界开展了通力协作以期能够开发出“一种可普遍采用的冠状病毒多反应监测分析方法”3。本文对新型电离技术UniSpray与电喷雾电离进行了比较,以进一步优化LC-MS检测方法(720006967ZH和720006968ZH)用于选定的SPIKE和NCAP胰蛋白酶解肽,并研究了该LC-MS方法在动态范围和选择性方面的潜在提升。
对重组SARS-CoV-2 SPIKE和NCAP蛋白(冻干品,由Cov-MS提供)进行联合酶解,并将得到的胰蛋白酶酶解Lys C肽段作为单独标准品分别加标至病毒采样管(Universal Transport Medium, UTM)基质中3。 在MRM分析模式下,将ACQUITY UPLC I-Class PLUS系统与Xevo TQ-XS串联四极杆质谱仪联用,分析得到的肽段。
|
液相色谱系统: |
ACQUITY UPLC I-Class PLUS |
|
样品瓶: |
采用MaxPeak HPS技术的QuanRecovery样品瓶 |
|
色谱柱: |
ACQUITY Premier BEH C18肽分析专用柱, 300 Å, 2.1 mm × 50 mm, 1.7 µm |
|
柱温: |
40 °C |
|
样品温度: |
10 °C |
|
进样体积: |
5 µL |
|
流速: |
0.6 mL/min |
|
流动相A: |
0.1%甲酸水溶液 |
|
流动相B: |
0.1%甲酸的乙腈溶液 |
|
质谱系统: |
Xevo TQ-XS |
|
电离模式: |
UniSpray和ESI正离子模式 |
|
采集模式: |
MRM |
|
毛细管电压(ESI+): |
0.5 kV |
|
撞击器电压(US+): |
0.7 kV |
|
碰撞能量: |
经过肽段/通道优化 |
|
锥孔电压: |
35 V |
|
时间(min) |
溶剂B (%) |
|---|---|
|
0.0 |
5 |
|
5.5 |
33 |
|
5.6 |
85 |
|
7.0 |
85 |
|
7.1 |
5 |
|
8.0 |
5 |
|
软件: |
MassLynx TargetLynx |
本研究中还应用了“剖析新型冠状病毒病(COVID-19):尽可能拓宽以多反应监测技术进行的SARS-CoV-2分析中LC-MS检测的动态范围”(720006968ZH)中所述的多重反应监测(MRM)方法,该方法属于Cov-MS联盟通过业界通力协作开发出的一部分3。 每个肽段使用两个离子通道以尽量提高占空比和信噪比,并且采用常规液相色谱方法和条件以便保持稳定性和通量。同时应用UniSpray和Electrospray离子源,并按Cov-MS原创标准操作程序(SOP)中所述的步骤以相同的稀释系列分析样品。
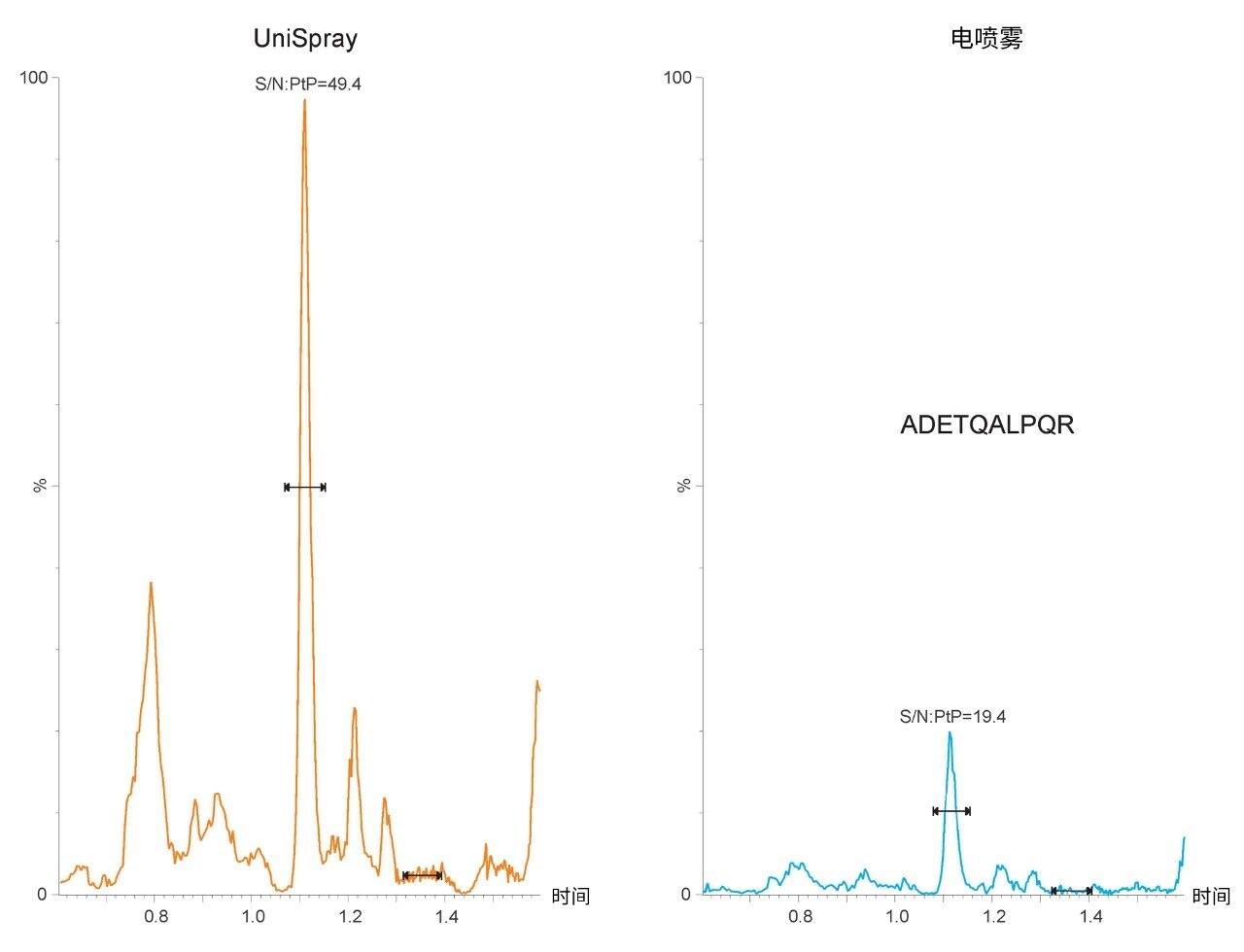
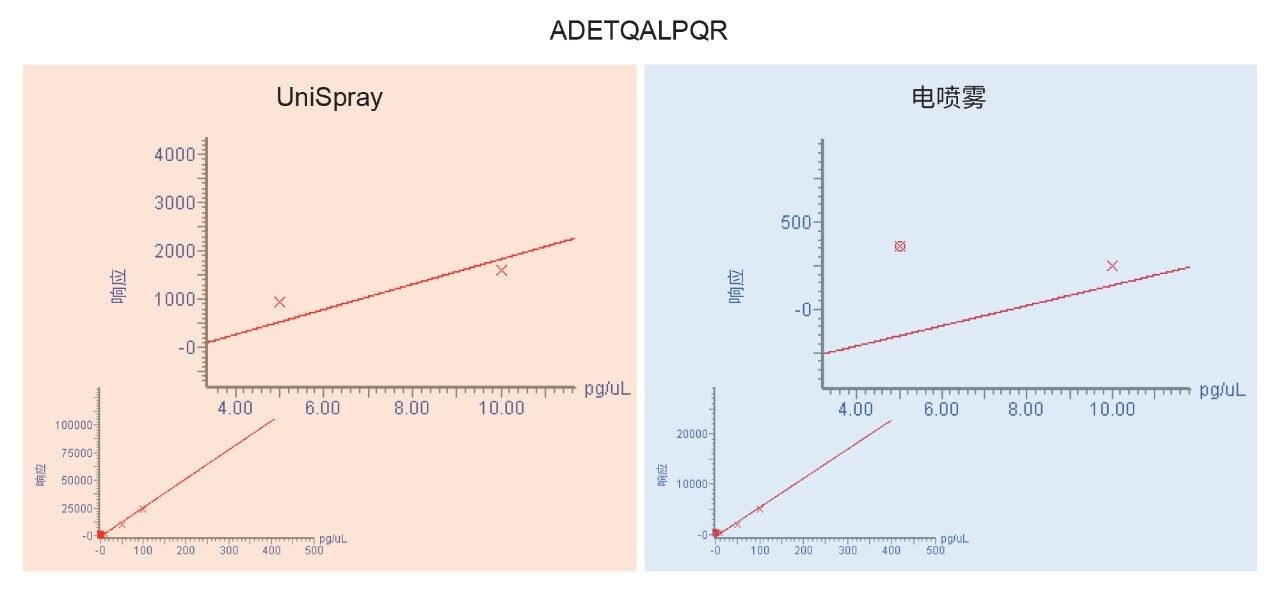
图1所示的典型色谱图表明,与电喷雾方法相比,使用UniSpray可以得到更高的信号强度。在本例中,UniSpray相比电喷雾方法还提供了更出色的信噪比。柱上进样相同含量的蛋白质酶解物获得的肽段信噪比增益大约为2.5倍,与先前报道的肽分析性能指标一致4。 图2展示了信噪比提升的优势,图中所示为UniSpray和电喷雾方法分析P0DTC9|NCAP_SARS2中的ADETQALPQR肽段所获得的定量响应。ADETQALPQR肽段先前被鉴定为响应中等偏上的肽段之一,柱上进样涵盖四种含量水平。对于这种肽和基质,使用UniSpray可以获得额外的含量水平,同时在残差和线性回归方面不影响定量性能。
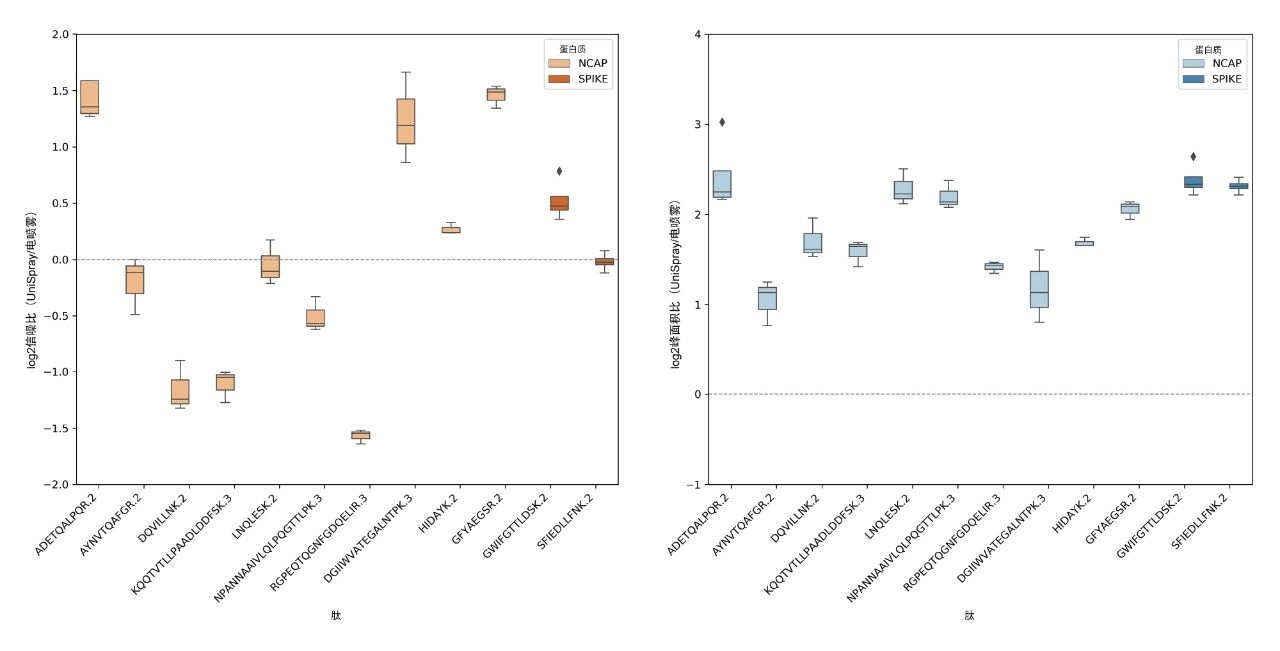
比较结果汇总见图3,其中对比了Cov-MS SOP中规定的NCAP和SPIKE SARS-Cov-2蛋白肽段的所有MRM色谱图的峰信噪比和峰面积,展示了UniSpray和Electrospray离子源的互补性。通过表现给定肽在特定含量水平的信噪比并与相同含量水平下相同肽的信噪比进行对比,计算每种肽的平均信噪比和范围。接下来,对于检出肽段的所有含量水平,使用四分位数分布表示全部信噪比值的平均值和置信区间,如图3左侧的比值集所示。平均而言,使用UniSpray使大约三种肽表现出信噪比提升,与使用电喷雾方法时表现出信噪比提升的肽数量类似。但是,具备可以选择或使用的替代技术对于更可靠地检测给定基质(即,鼻咽拭子、唾液、漱口液等)中的特定SARS-Cov-2肽至关重要。图3右侧的分布集展示了两种电离技术得到的峰面积比,进一步确认了图2所示的观察结果以及之前的研究,即使用UniSpray离子源可以增加总体峰面积(平均提升至电喷雾技术的4倍),提供更优质的离子统计数据,从而潜在地改善了较低数据信号水平下的重现性(数据未显示)4。
由于NCAP和SPIKE蛋白是病毒SARS-CoV-2补体的关键组分,并且是病毒载量的直接量度,因此考虑采用LC-MS技术来测定其在生物基质中的含量和浓度。本文研究了在UTM基质中检出的许多NCAP和SPIKE胰蛋白酶解肽的线性响应和LLOD,以了解UniSpray和电喷雾离子源的相对响应,进一步表征Cov-MS联盟正在开发的MRM分析方法。所得结果表明,UniSpray和电喷雾方法是蛋白酶解肽的互补电离方法,开发的Xevo TQ-XS串联四极杆质谱仪方法能够检测并定量鼻咽拭子中以及保存在病毒采样管(Universal Transport Medium)中的SARS-CoV-2蛋白,使用肽段子集可使该方法的能力进一步增强。
感谢Cov-MS联盟在SARS-Cov-2 MRM方法设计的业界通力协作内容中提供评价试剂盒。
Stuart Oehrle、Laurence Van Oudenhove、Jan Claereboudt和Hans Vissers(沃特世公司);Bart Van Puyvelde、Simon Daled、Dieter Deforce和Maarten Dhaenens(根特大学医药生物技术实验室);Katleen Van Uytfanghe(根特大学生物分析系)。
720007054ZH,2020年9月