介绍BioResolve SCX mAb色谱柱的设计和性能,以及其提供更高的分离度、更出色的载样量和绝佳重现性的能力。
使用BioResolve SCX mAb色谱柱可以改善电荷异构体的LC分析,从而可以轻松地得到更加可靠、分离度更高的分离结果。这款新型色谱柱运用了沃特世专门设计的聚合物无孔颗粒技术,该技术采用经过优化的多重键合填料,可为mAb分离提供稳定的高分离度。
蛋白质分析通常使用离子交换色谱(IEX)研究电荷异质性。尤其在生物制药行业,常利用IEX对蛋白类治疗药物(例如单克隆抗体(mAb))的电荷异构体进行日常表征和监测。这些电荷异构体通常与药物疗效有关,因此常被标记为关键质量属性1。
从某些方面来看,电荷异质性分析能用的方法较少。虽然毛细管电泳法和采用离子吸附剂作为固定相的LC分离法是获取详细电荷异构体信息的常用方法,但一直以来,这两种方式始终需要解决分离度限制以及有关方法实施和耐用性方面的挑战。LC方法能够轻松进行馏分收集并具有多维功能,尤其能够促进结构-功能研究和详细的二次分析,因此可用于进一步方法开发。
使用BioResolve SCX mAb色谱柱可以改善电荷异构体的LC分析,从而可以轻松地得到更加可靠、分离度更高的分离结果。这款新型色谱柱运用了沃特世专门设计的聚合物无孔颗粒技术,该技术采用经过优化的多重键合填料,可为mAb分离提供稳定的高分离度。本应用纪要介绍了BioResolve SCX mAb色谱柱的设计和性能,以及其提供更高的分离度、更出色的载样量和绝佳重现性的能力。
用18.2 MΩ水将NIST mAb(参比物质8671)、阿达木单抗、曲妥珠单抗、英夫利昔单抗稀释至5 mg/mL或2.5 mg/mL的浓度(具体详见下文)。
|
仪器: |
配备钛(5 mm,1500 nL)流通池的ACQUITY UPLC H-Class Bio |
|
数据管理: |
Empower 3 |
|
色谱柱: |
沃特世样品色谱柱,BioResolve SCX mAb, 3 µm(包括4.6 x 50 mm) 竞争对手SCX,3 µm |
|
流动相A: |
100 mM MES水合物 |
|
流动相B: |
100 mM MES钠盐 |
|
流动相C: |
1 M氯化钠 |
|
流动相D: |
18.2 MΩ水 |
|
流速: |
0.72 mL/min(4.6 mm内径) 0.54 mL/min(4.0 mm内径) 0.15 mL/min(2.1 mm内径) |
|
柱温: |
30 °C |
|
检测(UV): |
20 Hz,280 nm |
|
进样体积: |
5 µL(5 mg/mL mAb样品) |
|
样品管理器清洗液: |
18.2 MΩ水 |
|
密封清洗液: |
10% HPLC级甲醇/90% 18.2 MΩ水(v/v)(间隔设置为0.5 min) |
|
时间 |
%A |
%B |
%C |
%D |
曲线 |
|---|---|---|---|---|---|
|
初始 |
2.2 |
17.8 |
1.0 |
79.0 |
初始 |
|
10.0 |
2.2 |
17.8 |
20.0 |
60.0 |
6 |
|
10.5 |
2.2 |
17.8 |
70.0 |
10.0 |
11 |
|
12.5 |
2.2 |
17.8 |
1.0 |
79.0 |
11 |
|
20.0 |
2.2 |
17.8 |
1.0 |
79.0 |
6 |
使用Auto•Blend Plus设置梯度,得到pH 7的缓冲体系:
|
仪器: |
配备钛(5 mm,1500 nL)流通池的ACQUITY UPLC H-Class Bio |
|
数据管理: |
Empower 3 |
|
色谱柱: |
BioResolve SCX mAb, 3 μm, 4.6 x 50 mm |
|
流动相A: |
20 mM MES pH 6.0 |
|
流动相B: |
20 mM MES pH 6.0,1 M NaCl |
|
流速: |
0.96 mL/min |
|
柱温: |
30 °C |
|
检测(UV): |
20 Hz,280 nm |
|
进样体积: |
4.8 µL (2.5 mg/mL NIST mAb) |
|
样品管理器清洗液: |
18.2 MΩ水 |
|
密封清洗液: |
70% HPLC级异丙醇/30% 18.2 MΩ水(间隔设置为0.5 min) |
|
时间 |
%A |
%B |
%C |
%D |
曲线 |
|---|---|---|---|---|---|
|
初始 |
99.0 |
1.0 |
0.0 |
0.0 |
初始 |
|
7.5 |
80.0 |
20.0 |
0.0 |
0.0 |
6 |
|
7.5 |
70.0 |
30.0 |
0.0 |
0.0 |
11 |
|
8.5 |
99.0 |
1.0 |
0.0 |
0.0 |
11 |
|
13.0 |
99.0 |
1.0 |
0.0 |
0.0 |
11 |
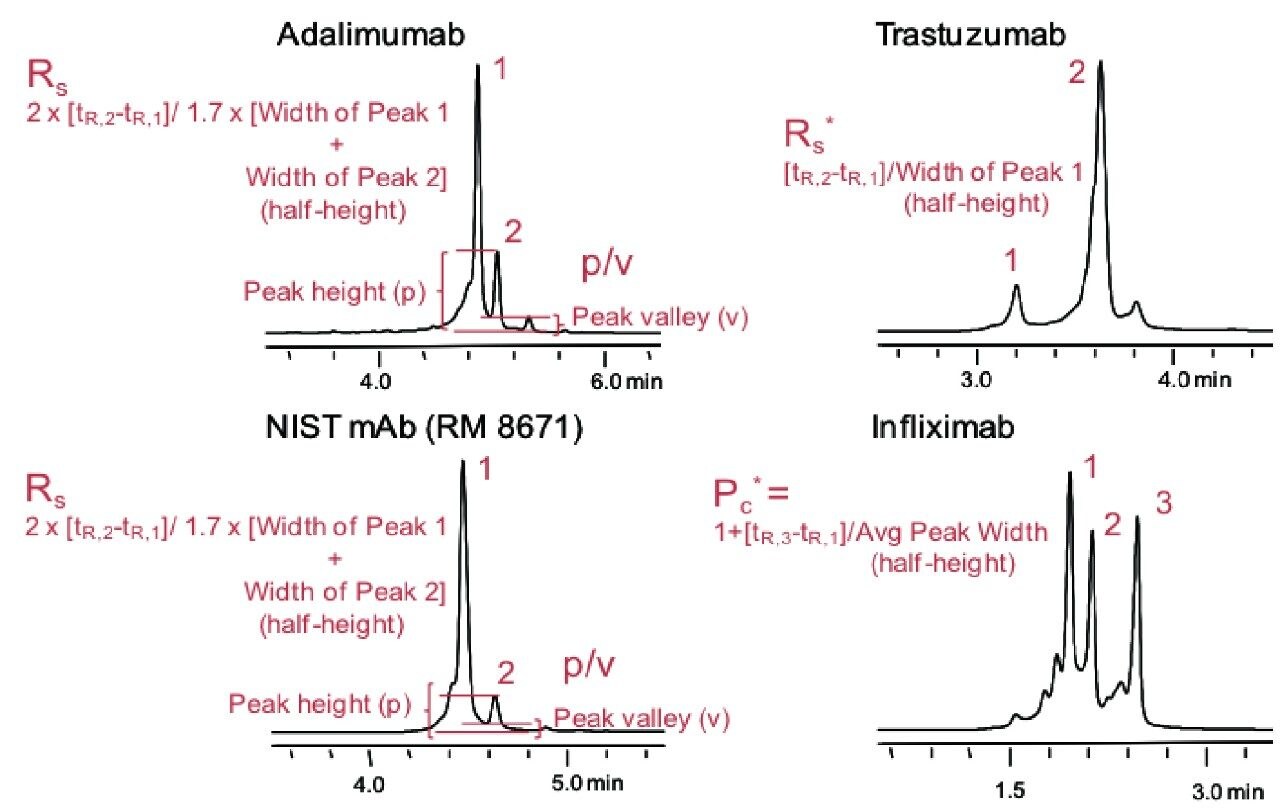
本研究选用了四种mAb(阿达木单抗、NIST mAb [RM 8671]、曲妥珠单抗和英夫利昔单抗),因为这四种mAb的pI值和保留行为各不相同。每种mAb的电荷异构体信息也不相同,因此可以在分离性能的评估过程中,利用不同的方式测量分离度。对于阿达木单抗和NIST mAb,可以通过测量峰谷比(p/v)或USP半高(HH)监测丰度最高的碱性异构体的分离度(Rs)。曲妥珠单抗的分离可产生大量酸性异构体,其峰形十分均匀。据此测量分离度(Rs*),从而追踪该物质相对于主峰的分离度,由于分离出部分前峰/肩峰,因此该物质本身的色谱峰不能进行峰宽测量。最后,利用离子交换法将英夫利昔单抗分离成多个峰,其中主峰和后面两个碱性异构体(对应于分子的等摩尔赖氨酸异构体)的含量最高。使用英夫利昔单抗的这三个峰,通过测量有效峰容量(Pc*)来评估色谱分离能力。下图更加详细的描述了上述每种测量方法(tR表示保留时间):
必须为单克隆抗体的分析和表征精心开发一套耐用、可重现的专用色谱工具。在为电荷异构体分析寻找新固定相的过程中,已经就如何最大程度上优化离子交换吸附剂提出了许多见解。
许多用于蛋白质分离的离子交换色谱柱已经投入市场,并出于合理原因而使用无孔聚合物颗粒。无孔颗粒可消除颗粒内扩散并最大程度降低大分子的谱带展宽。随着载样量明确的专用离子交换配体问世,似乎没有必要研究替代技术。3 µm无孔聚合物颗粒在离子交换固定相上的有效利用,可归功于三十年前所做的工作2。 最近,人们更加关注蛋白质电荷异构体分离的持续优化,以及将颗粒直径减少到3 µm以下是否有益。
为此,制备了两个离子容量相当的原型固定相,其唯一差别是粒径不同(3.1 µm和1.7 µm)。分别用这两种固定相分离阿达木单抗,生成的色谱图如图1所示。
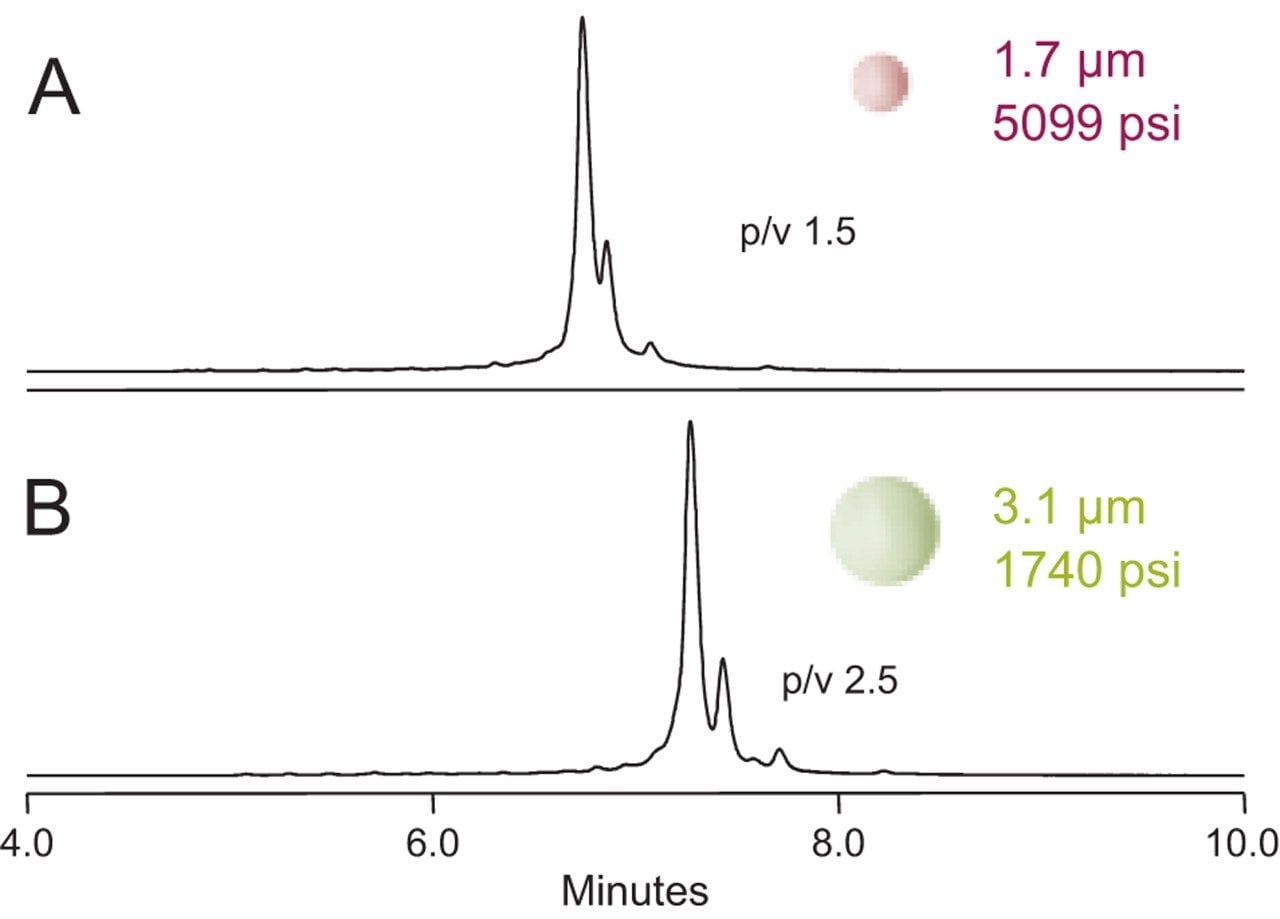
在二者均使用低扩散LC系统(系统谱带展宽<12 µL)的前提下,3.1 µm固定相得到的分离效果略优于1.7 µm固定相。简而言之,虽然mAb是150 kDa蛋白质,扩散系数非常低,但基于形态对传质的限制来看,减小无孔颗粒尺寸几乎没有任何价值。此外,柱压也大不相同:填充3.1 µm颗粒的2.1 × 50 mm色谱柱,最大压力为1740 psi;而1.7 µm色谱柱的最大压力为5099 psi。由此可以合理推断,此压力差对分离会产生一定影响。在单独的实验中,为英夫利昔单抗的分离增加限流器,确实观察到色谱峰随着压力增加而略微变宽(数据未显示)。虽然有一定的蛋白质依赖性,但加压可以迫使蛋白质内部的结构域发生水合作用,从而暂时扰乱构象状态3。 因此,优先选择开发约3 µm的无孔固定相,该固定相对mAb分离具有更佳的分离效果,并且支持在多个LC平台上进行分离,无需考虑压力限制。
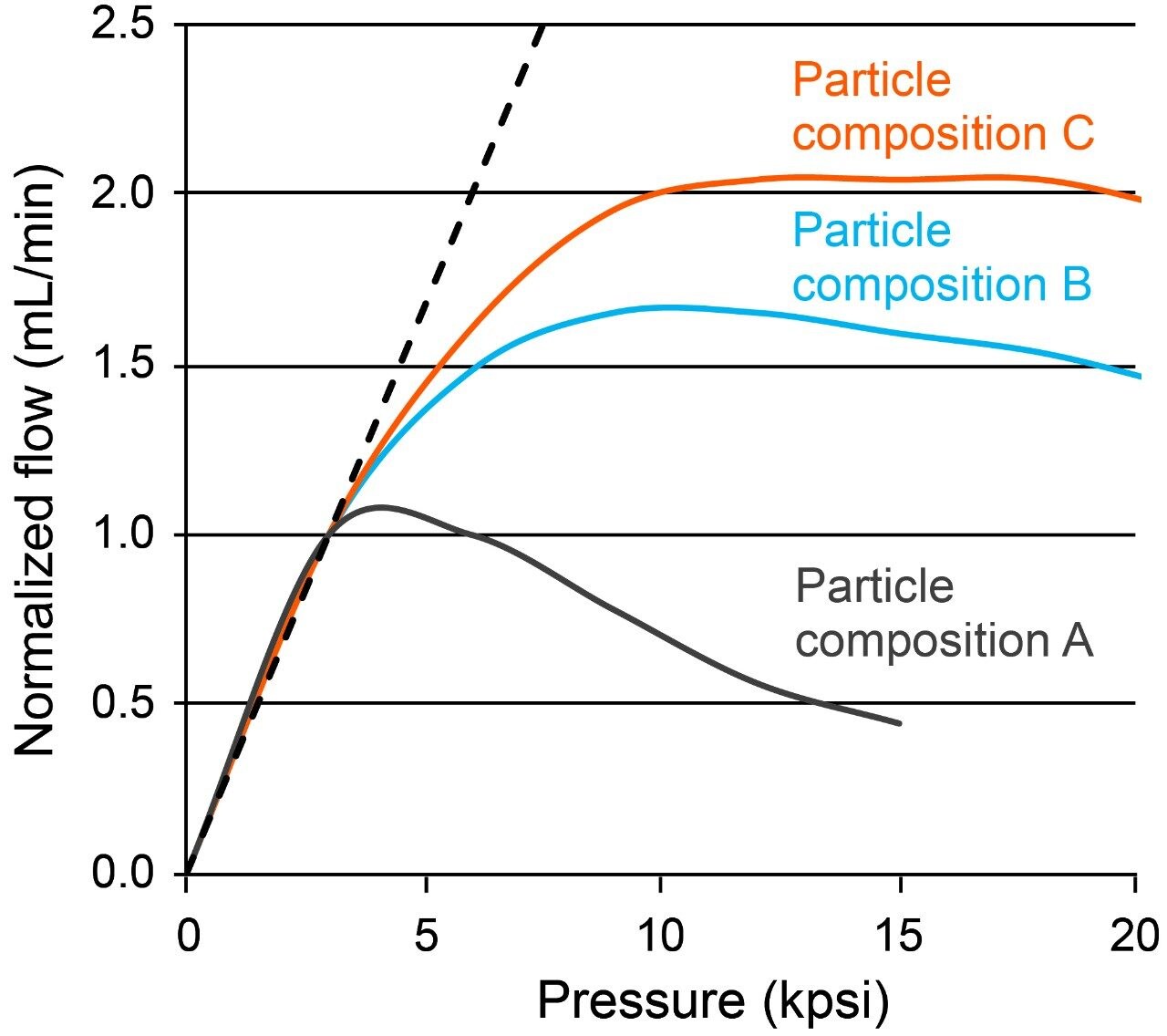
这种3 µm无孔固定相将有可能频繁应用于1000~9000 psi的压力条件下。但是,为确保柱床稳定性,其承受额外压力的能力也必不可少。如果颗粒的聚合物组分没有进行充分优化,其在较高的线速度下可能会破裂或产生延展性,从而导致色谱柱过早失效。为此,对许多基质颗粒的聚合物组分进行了研究,并进行了机械强度测试。该测试在高达21000 psi的恒定压力下使用甲醇作为流动相测试短柱。 测试中观察到的流速如图2所示,可用于指示颗粒强度和柱床的机械稳定性。理想色谱柱应当呈现一对一的压力和流速对应关系。
某些组分(例如组分A)的流速(2.0)偏差低至5000 psi,而其它组分(例如组分C)在达到甚至超出10000 psi后仍展现出相当优异的机械属性。后一种结果代表了新设计的基质颗粒,及其对较高线速度和较高流速方法条件的适应性。
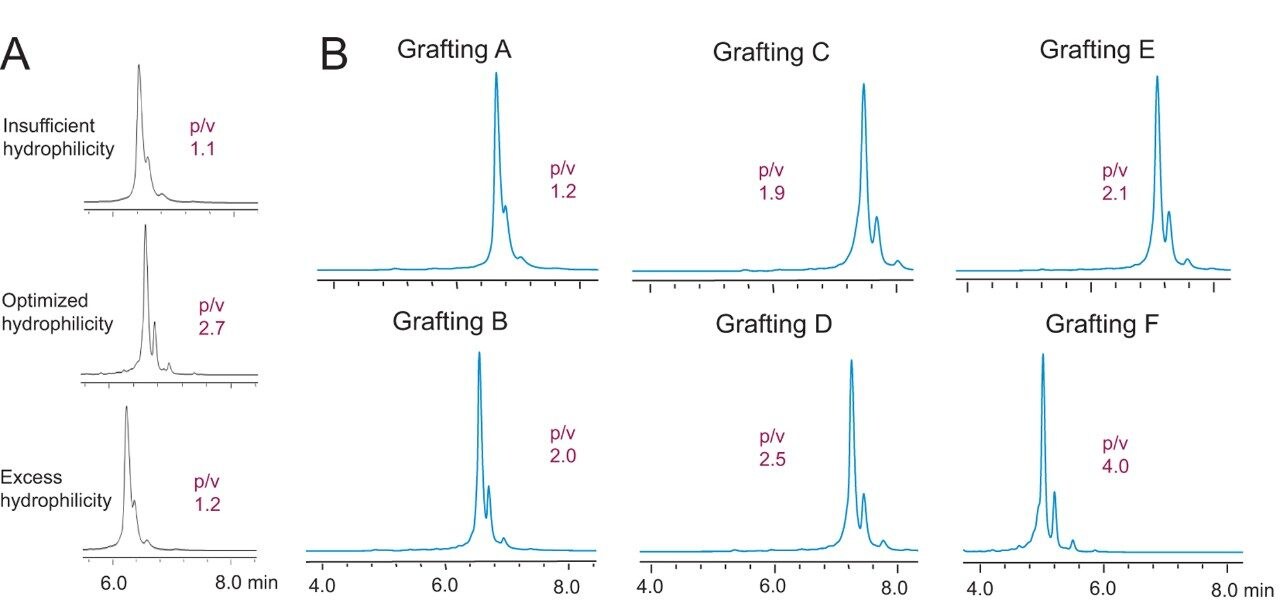
蛋白质相互作用取决于许多因素,影响方式非常复杂。离子交换过程以色谱吸附的形式进行,这正确地预测了调节吸附剂表面填料的重要性。在针对mAb电荷异构体分析开发经过优化的填料时,必须首先考虑明确该分析属于天然水性分离,需要排除疏水性次级相互作用。因此修改新基质颗粒的表面以增加和优化其亲水性。为此,用三种亲水性不同的基质颗粒进行修改,产生三种不同的原型,每种原型随后用相同的离子交换配体进行制备。
使用这些原型分离阿达木单抗产生的色谱图如图3A所示。结果表明中等程度的修改可以优化分离度。亲水改性剂过少时可能会发生不利的疏水性次级相互作用。亲水改性剂过多时,不仅分离度低,柱压也非常高。了解最佳亲水性范围可以为稳定生产这种新型BioResolve颗粒提供精确的指导。
同样仔细考虑了离子交换配体接枝的优化。通过实验设计和多种原型的性能表现指导了许多轮合成优化。首先,有理由认为开发阳离子交换吸附剂的价值最高,因为大多数mAb的pI值均表现为碱性4。 接下来,为提供经过优化的离子容量、有效的配体分布,以及控制可能因电荷间排斥而发生的溶胀,需要考虑离子交换接枝的化学性质。前期工作确定,采用磺酸配体的强阳离子交换配体最具有开发前景。由于种种原因,观察到当用于pH梯度色谱时,磺酸配体的平衡时间相对于羧酸基团更短。因此将重点放在研究用不同化学组成的磺酸配体所制备原型的有效性。图3B为更多原型组的六张示例色谱图。根据阿达木单抗的分离情况可以看出,这些不同的化学组成会影响峰形、峰尖锐程度和分离度。例如,接枝C生成的阿达木单抗谱图,保留时间较大,但分离度相对较低。而接枝F的保留时间最低,分离度最高,色谱图结构较好。后一种原型即为所需的离子交换配体化学组成。综上所述,上述各优化构成了BioResolve SCX mAb固定相的基础,即最好使用由专门的聚合反应和精细调节的磺酸配体制成的3 µm无孔吸附剂(图4)。
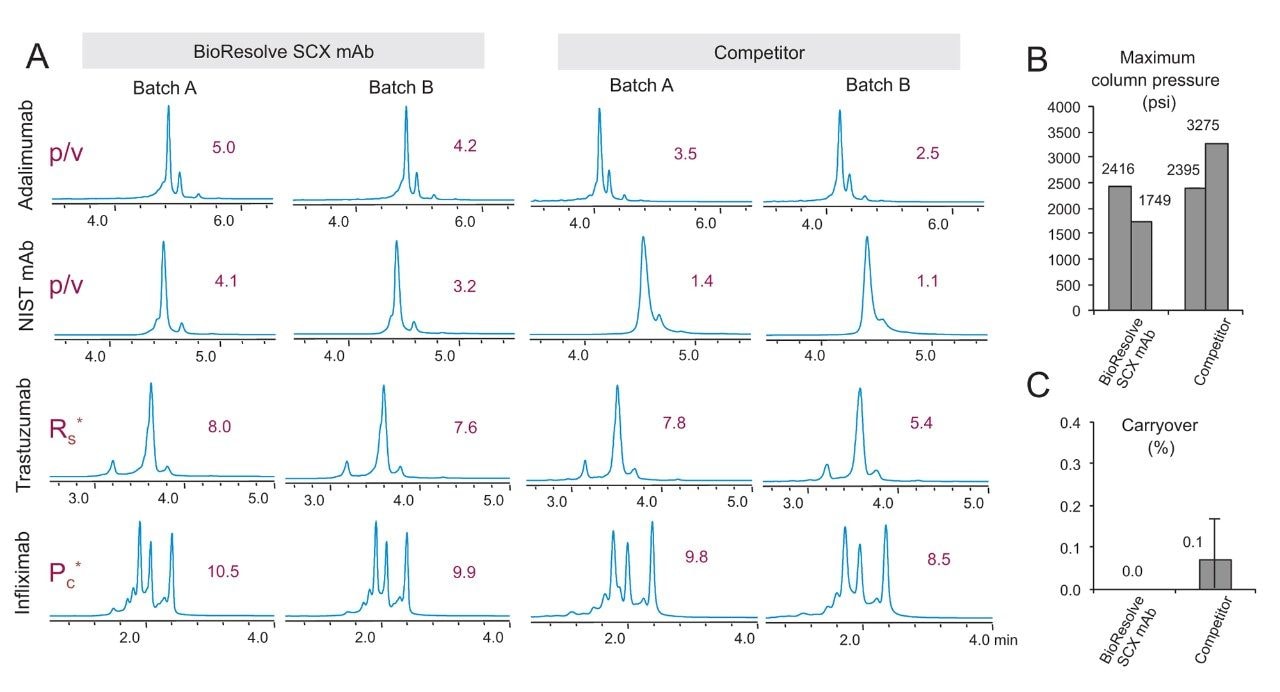
生物制药发现、开发和潜在质量控制过程中使用的每种新分析工具都应该具有更高的性能和严格的稳定性。因此,使用四种单克隆抗体,即英夫利昔单抗、曲妥珠单抗、NIST mAb和阿达木单抗,在基于MES、pH 7的快速盐梯度下定期测试了BioResolve SCXmAb色谱柱。为各分离设计单独的分离度指标,用于评估分离程度,详细计算请参阅实验部分。利用反馈监控固定相开发过程可确保分离普遍具有高性能,我们将避免仅优化一小部分mAb亚基的选择性。使用两根BioResolve SCX mAb色谱柱和两批不同填料得到的色谱图凸显了这种普遍性,如图5所示。另还附有使用一种领先的替代色谱柱技术得到的色谱图。无论从峰容量(Pc)、分离度(Rs)还是峰谷比(p/v)来看,BioResolve SCX mAb色谱柱呈现的分离效果都更加出色。从NIST mAb电荷异构体分离示例中可以明显看出分离度改善。只有在使用BioResolve SCX mAb色谱柱的情况下,NIST mAb酸性异构体的前延肩峰才能从主峰中分离出来。此外,使用BioResolve色谱柱时进样间残留更低,压力相当或更低(图5B和C)。
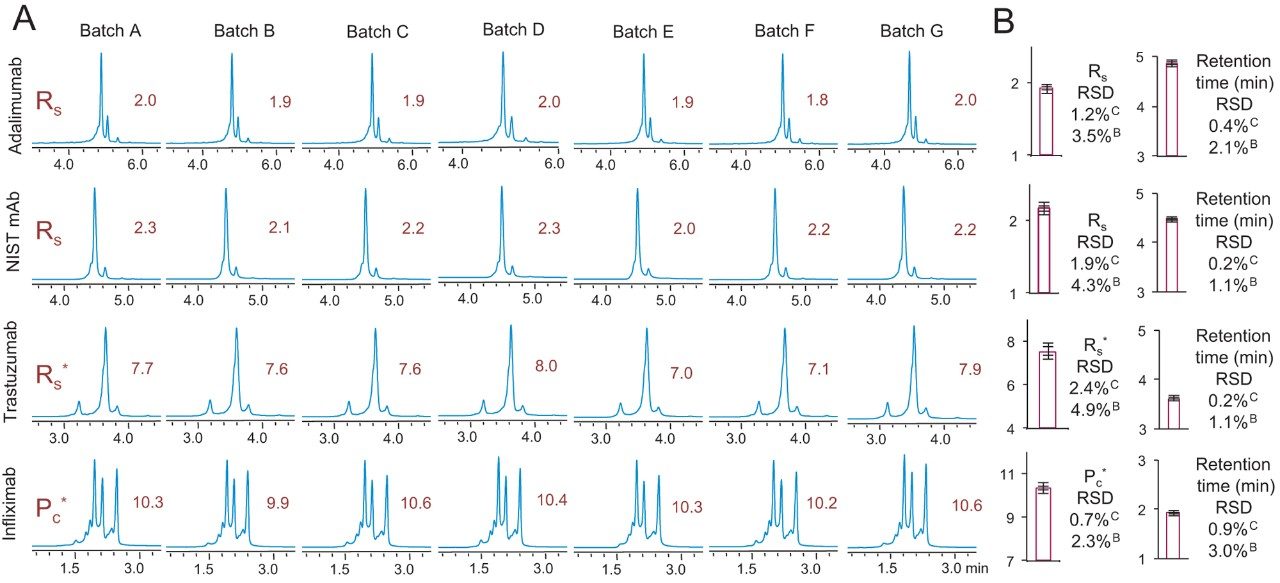
对七个不同批次的BioResolve SCX mAb固定相进行范围更大的类似测试,评估重现性。图6所示为此分析中获得的色谱图。右侧图表为平均性能对应的保留时间和分离度指标。每个图表值都标有两个误差棒,用来表示重现性。第一个误差棒表示观察到的色谱柱间标准偏差,数据来源于对七根装填有同一批固定相的色谱柱进行的研究。色谱柱间重现性对应的RSD值标记有上标C,保留时间的RSD值为0.9%或更低,分离度指标RSD为2.4%或更低。第二个误差棒表示观察到的批次间重现性,数据来源于七个不同批次的固定相。此差异的RSD值标记有上标B,保留时间的RSD值为3.0%或更低,分离度指标RSD为4.9%或更低。因此,可以认为BioResolve SCX mAb色谱柱具有高可靠性,因为它不仅能提供极高的分离度,还能发挥出色的重现性,足以满足方法验证以及新分析的持续实施。
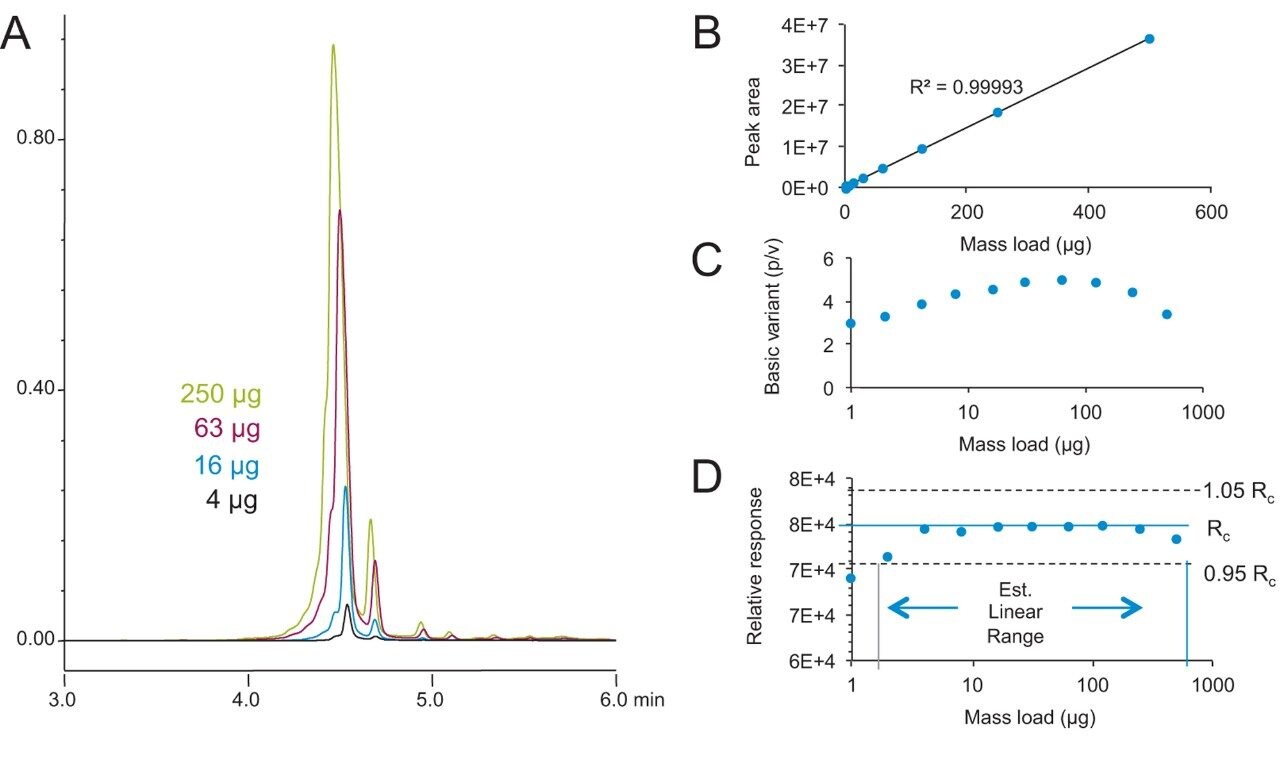
IEX色谱柱技术的载样量也很重要,尤其是通过分离电荷异构体采集馏分进行结构功能研究,从而解决合规问题时。使用BioResolveSCX mAb, 4.6 × 50 mm色谱柱,研究NIST mAb分离随载样量从1 μg增加至500 μg的变化。载样量分别为4、16、63、250 µg时采集的色谱图如图7A所示,图7B–D分别为峰面积、碱性异构体分离度和相对响应图。在该载样量范围内观察到出色的峰面积线性(R2 = 0.9999),仅在结束载样量250和500 µg处,分离度有微小的降低。因此,该色谱柱技术可以用于载样量和馏分分离更大的应用。根据上述数据,4.6 mm内径色谱柱可以在载样量高达1 mg甚至2 mg(取决于样品性质)时维持卓越的分离度。
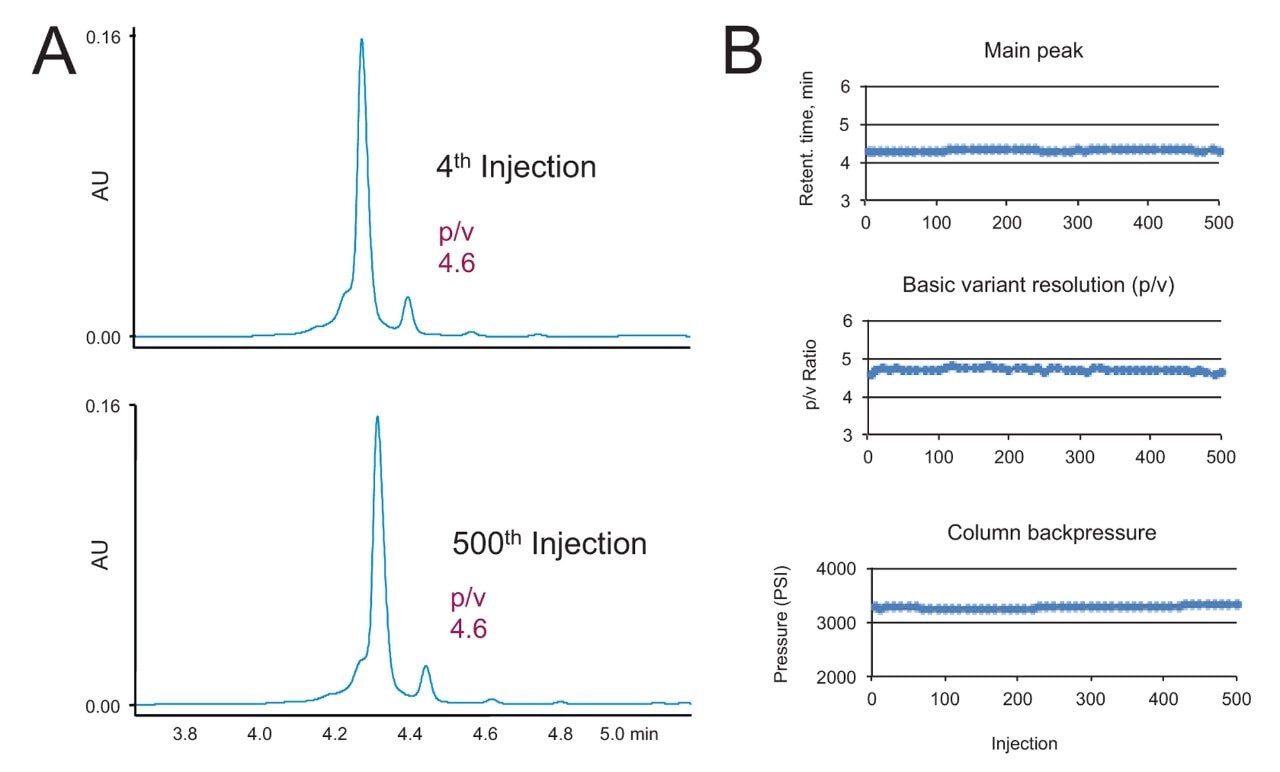
此外,还在稳定性试验中测试了BioResolve SCX mAb, 4.6 × 50 mm色谱柱的使用寿命,测试方式为在极高流速0.96 mL/min下进样500次NIST mAb进行重复分离。图8A显示了测试中第4次至第500次进样的色谱图,可以看到分离效果基本保持不变。在两个案例中都观察到部分分离的酸性异构体前峰,这是NIST mAb电荷异构体谱图的特征。如图8B所示,在使用寿命测试期间,保留时间、分离度和柱压基本上没有变化,也进一步证实了色谱柱性能的一致性。
本研究开发了基于3 µm无孔吸附剂、专门的聚合反应和精细调节的磺酸配体的全新IEX色谱柱技术,改善单克隆抗体的电荷异构体分析。我们通过有目的地选择和优化粒径、颗粒形态和表面填料,开发出与其它领先技术相比,性能更优异的色谱柱。色谱柱的性能已被证实可通用于多种mAb,其色谱柱间差异和批次间差异极小,色谱柱使用寿命极佳,因此证明该色谱柱具有重现性和稳定性。此外,该色谱柱载样量大,在纯化电荷异构体用于表征和结构-功能研究时非常有益。我们相信,这款新一代IEX色谱柱技术凭借其重现性和更高的性能,将更好地为生物制药科学家所用,即使是对mAb电荷异构体进行最复杂的研究、最严格的QC监测,他们都能轻松应对。
720006475ZH,2019年1月