
本应用展示了SPE捕获萃取过程在2D-LC-MS/MS分析法分析尿液中微囊藻毒素时的有效性。
藻类“水华”是淡水中常见的一种环境问题,发生原因为蓝细菌聚集。它们的产生主要与地表径流中过量的营养物(肥料)有关。许多常见的蓝细菌会产生强效的蓝藻毒素,这些蓝藻毒素会对健康构成严重威胁,甚至导致当地野生生物和人类死亡。微囊藻毒素由最受关注、分布最广的蓝细菌1,2“铜绿微囊藻”产生,该毒素的名称也由此而来。微囊藻毒素在释放后可能持续存在数周至数月,因为它们不挥发,具有亲水性,在阳光下稳定,并且可在较宽的温度/pH范围内保持稳定。从化学角度来看,微囊藻毒素是通过非核糖体肽合成酶产生的环状七肽。微囊藻毒素包含一个七元肽环,该肽环由五个非蛋白氨基酸和两个蛋白氨基酸组成。这两种蛋白氨基酸是区分不同微囊藻毒素的关键所在,而其它氨基酸在不同微囊藻毒素中几乎保持不变。使用氨基酸单字母代码命名法,根据可变氨基酸的种类(构成微囊藻毒素结构)对各种微囊藻毒素进行命名。微囊藻毒素-LR因包含亮氨酸(L)和精氨酸(R)等可变氨基酸而得名。微囊藻毒素-LR最早完成鉴定,也是迄今为止研究最多的一种。其他常见的微囊藻毒素包括RR、YR(含酪氨酸(Y)和LA(含丙氨酸(A))。
饮用水中的微囊藻毒素不受US EPA监管,但作为不受监管的微生物饮用水污染物被列入US EPA污染物候选清单(CCLs) 1和2中的“蓝细菌及其毒素”下。某些蓝藻毒素(具体包括鱼腥藻毒素-A、微囊藻毒素-LR和柱孢藻毒素)被列于US EPA CCL3中。世界卫生组织3 (WHO)根据非癌症终点对每日可耐受摄入量(TDI)进行了评估。根据小鼠肝脏毒性研究结果可知,每日可耐受摄入量为每日每千克体重0.04微克(即,0.04 μg/kg/d)。TDI被视为微囊藻毒素的每日最大安全剂量。WHO还依据该TDI值将微囊藻毒素LR的饮用水浓度限值确定为1.5 μg/L。在该研究中,他们假设体重为60 kg(132磅)的人每天饮用2 L水,而这2 L水中有80%的来源受到污染。此外,已有研究证明,受微囊藻毒素污染的淡水排入海洋也会对污染区域的海洋生物产生致命影响。
人们食用受污染的海洋生物可能导致微囊藻毒素暴露,甚至死亡。研究人员已经针对微囊藻毒素分析开发出多种分析技术,包括小鼠生物试验4、磷酸酶抑制5试验、酶联免疫吸附试验(ELISA)6和反相高效液相色谱(RP-HPLC)7-8等。几乎没有研究采用多维色谱,因此,我们利用二维(2D)液相色谱-质谱联用技术(LC-MS/MS)开发出一种方法,对生物体液中的微囊藻毒素RR、LR和YR进行法医尸检分析9-11。
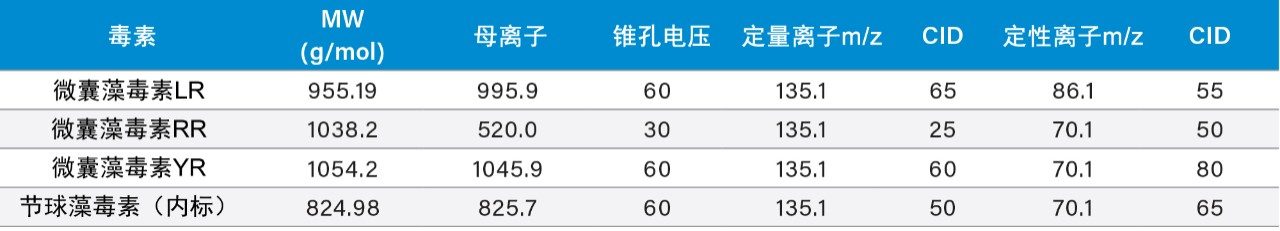
本实验针对每种微囊藻毒素均选择并优化了两个MRM通道(分别用于定量和确证)。MRM条件列于表1中。对于本应用来说,为多残留分析找到最佳的萃取和色谱条件是一项极大的挑战。利用沃特世公司(美国马萨诸塞州米尔福德)提供的几种捕集柱填料(Oasis HLB、XBridge C18和XBridge C8)和一种分离柱填料(BEH C18)对色谱条件进行了测试。还使用自动化6 × 6流程对上样条件(低pH、高pH和中性pH)和洗脱流动相(低pH和高pH下的甲醇或乙腈)进行了优化。所有微囊藻毒素标准品均购自Enzo Lifesciences(图1)。所有溶剂均为LC级或更高级别,购自Fisher Scientific(美国新泽西州费尔劳恩)。甲酸和氢氧化铵购自Sigma Aldrich(美国密苏里州圣路易斯)。萃取过程采用经过提前活化的反相吸附剂(Oasis HLB SPE 3 cc 60 mg柱管,沃特世公司(美国马萨诸塞州米尔福德))进行捕获萃取以筛选萃取条件。
|
色谱柱: |
Oasis HLB 20 μm–80 mg, 2.1 × 30 mm |
|
上样: |
MilliQ水(pH 7,无添加剂) |
|
流速: |
2 mL/min |
|
柱头稀释: |
5%(0.1 mL/min上样泵和2 mL/min稀释泵) |
|
系统: |
采用2D技术的ACQUITY UPLC,配置为“捕集和洗脱”,带柱头稀释功能 |
|
运行时间: |
10 min |
|
色谱柱: |
ACQUITY UPLC BEH C18, 1.7 μm, 2.1 × 50 mm(部件号:186002350) |
|
柱温: |
60 °C |
|
流动相A: |
水 + 0.5%甲酸 |
|
流动相B: |
乙腈+ 0.5%甲酸 |
|
梯度洗脱: |
流动相B在5 min内以线性梯度从5%增加至95% |
|
流速: |
0.500 mL/min(洗脱泵) |
|
进样体积: |
100 μL |
|
系统: |
Xevo TQ-S |
|
电离模式: |
ESI+ |
|
毛细管电压: |
3.0 kV |
|
锥孔电压: |
90.0 V |
|
离子源温度: |
150 °C |
|
脱溶剂气温度: |
550 °C |
|
脱溶剂气流速: |
1100 L/h |
|
锥孔气流速: |
50 L/h |
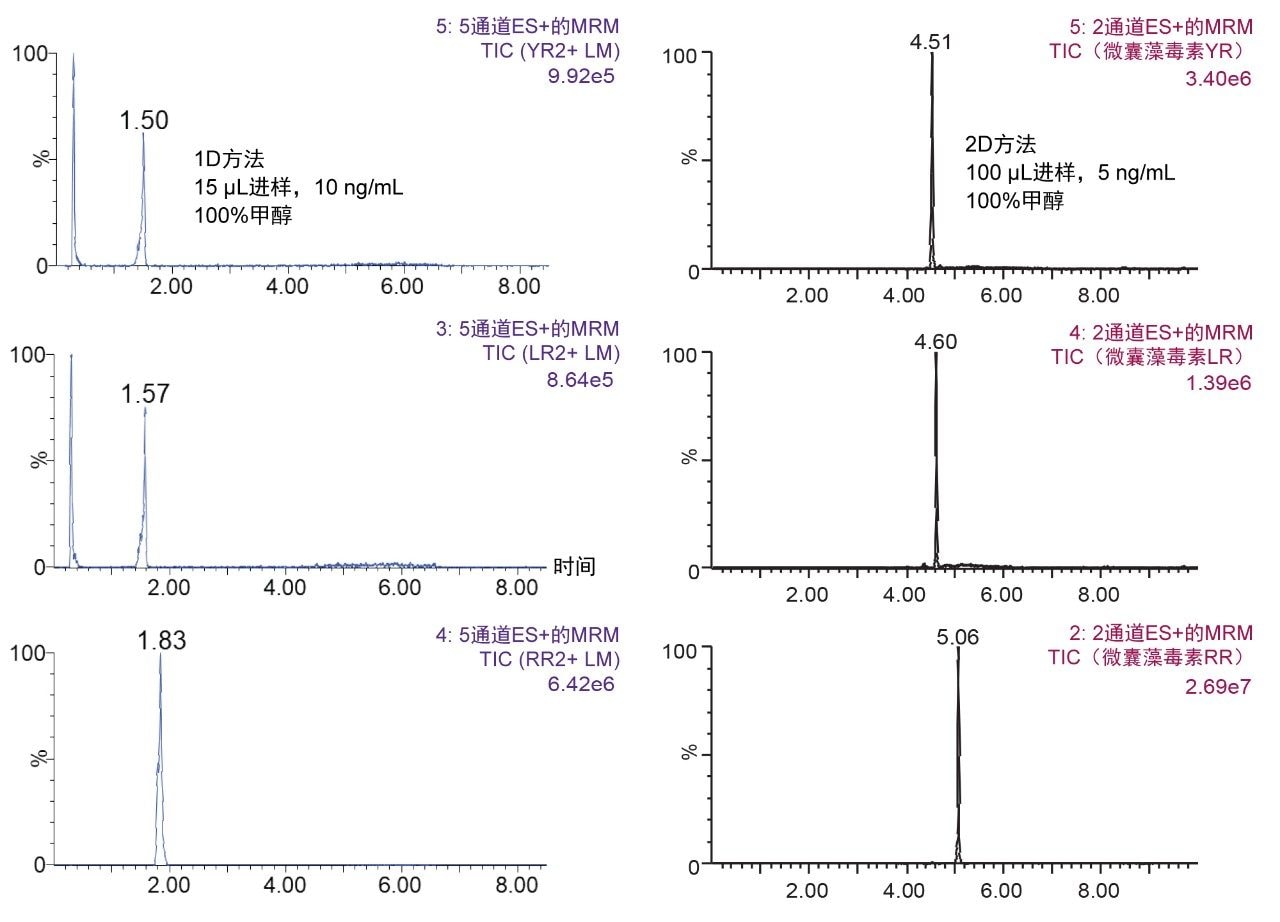
根据2D-LC 6 × 6洗脱方案(图2),利用水和有机标准品优化了各种微囊藻毒素的分离条件。微囊藻毒素为七肽,这类分子具有展现两性离子行为的潜力,并可能导致吸附问题或溶解度问题。利用多维色谱可提供多种选择,这是单维色谱分离无法实现的。柱头稀释(ACD)功能可选择进样100%有机提取物,进而减少50%的样品制备工作。图3对1D法进样15 μL乙腈与2D法进样100 μL乙腈所得结果进行了并排比较,图中清楚展示了多维色谱技术的通用性。1D法中有机提取物具有穿透效应已经不是新鲜事,多年来已有诸多文献报道。因此,采用捕集-洗脱ACD配置的2D系统所具备的大体积进样100%有机提取物的能力,可对样品制备方案产生重大的积极影响。
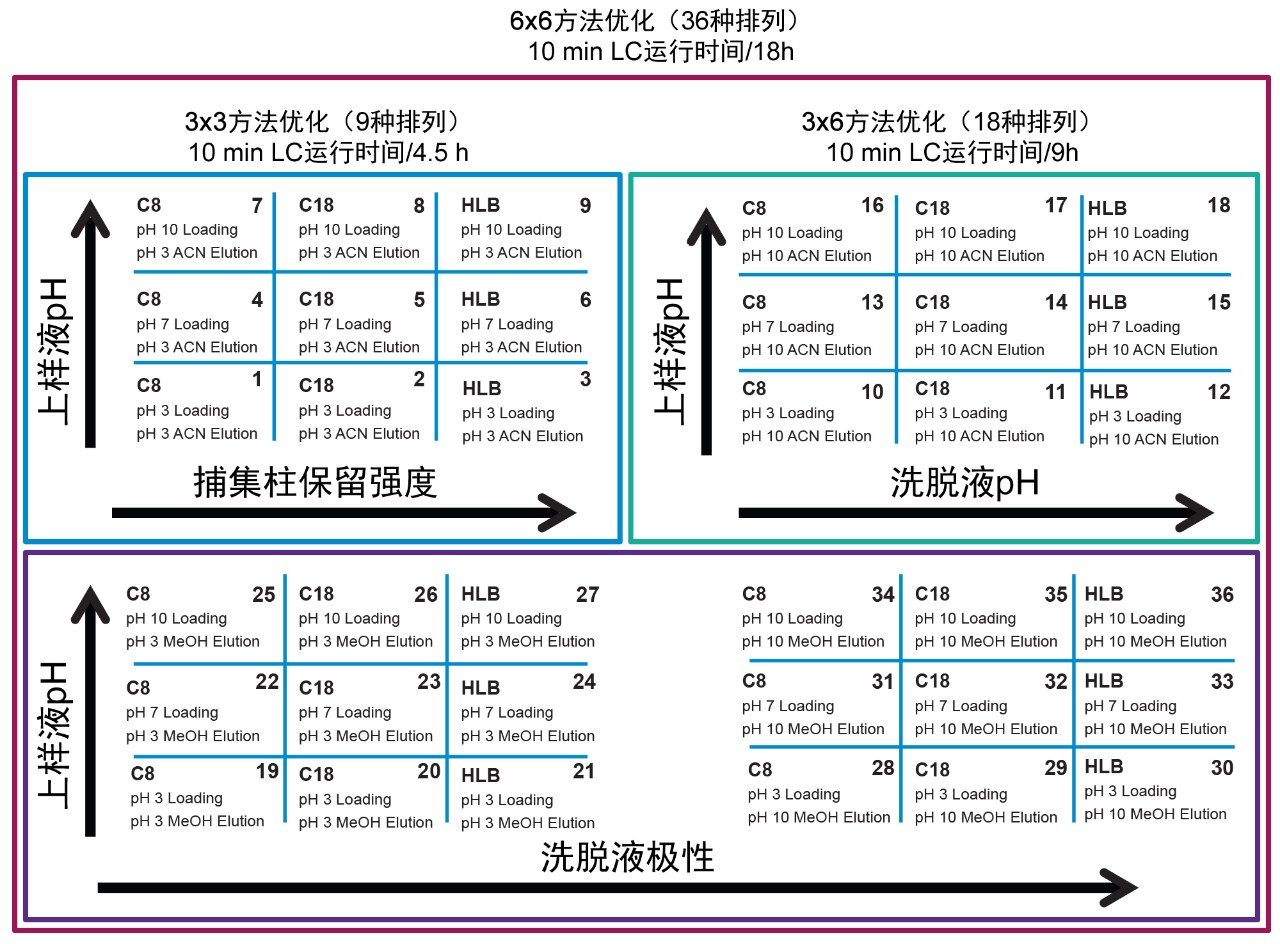
6 × 6网格结果见图4。通过优化四个关键参数,目标分析物可集中在第一维非常窄的谱带中,并以高斯分布转移至第二维。我们编制了36种不同方法,以便深入理解目标分析物的分离行为。该网格采用颜色编码,具有很强的可视化效果,有助于识别产生高斯分布的条件(绿色框)。如果一组条件产生的信号发生任何类型的色谱畸变(即,前沿峰、分裂峰、拖尾峰、肩峰等),则相应的结果将用黄色框标记。所有不存在的信号将以红色框突出显示。总体而言,微囊藻毒素YR显示,在总共36种方法中,多达25种方法(水性标准品和有机标准品)或29种方法(仅有机标准品)将产生高斯分布。比较水性标准品与甲醇或乙腈标准溶液的目的在于,研究标准品在水性条件下储存于玻璃样品瓶中时,在玻璃表面发生吸附或非特异性结合的可能性。对于每种微囊藻毒素,将所有36种方法的结果汇总后,下一步是确定可用于所有三种目标分析物的方法。在本例中,由于仅含三种分析物和一种内标,因此图5中的结果交叉参考了针对每种微囊藻毒素的甲醇和乙腈标准溶液使用的所有36种方法。汇总过程中清除了所有黄色和红色结果,仅重点关注高斯分布(绿色框)和最高强度的峰。对每种方法进行评分,将得分最高的方法结果于远端列中突出显示,其中列出可用于本应用的方法。在本例中,可选择28种方法分析微囊藻毒素YR、LR和RR,其中以节球藻毒素作为内标。本应用选择方法14,使甲醇和乙腈标准溶液中的所有四种分析物均获得最高的信号强度。


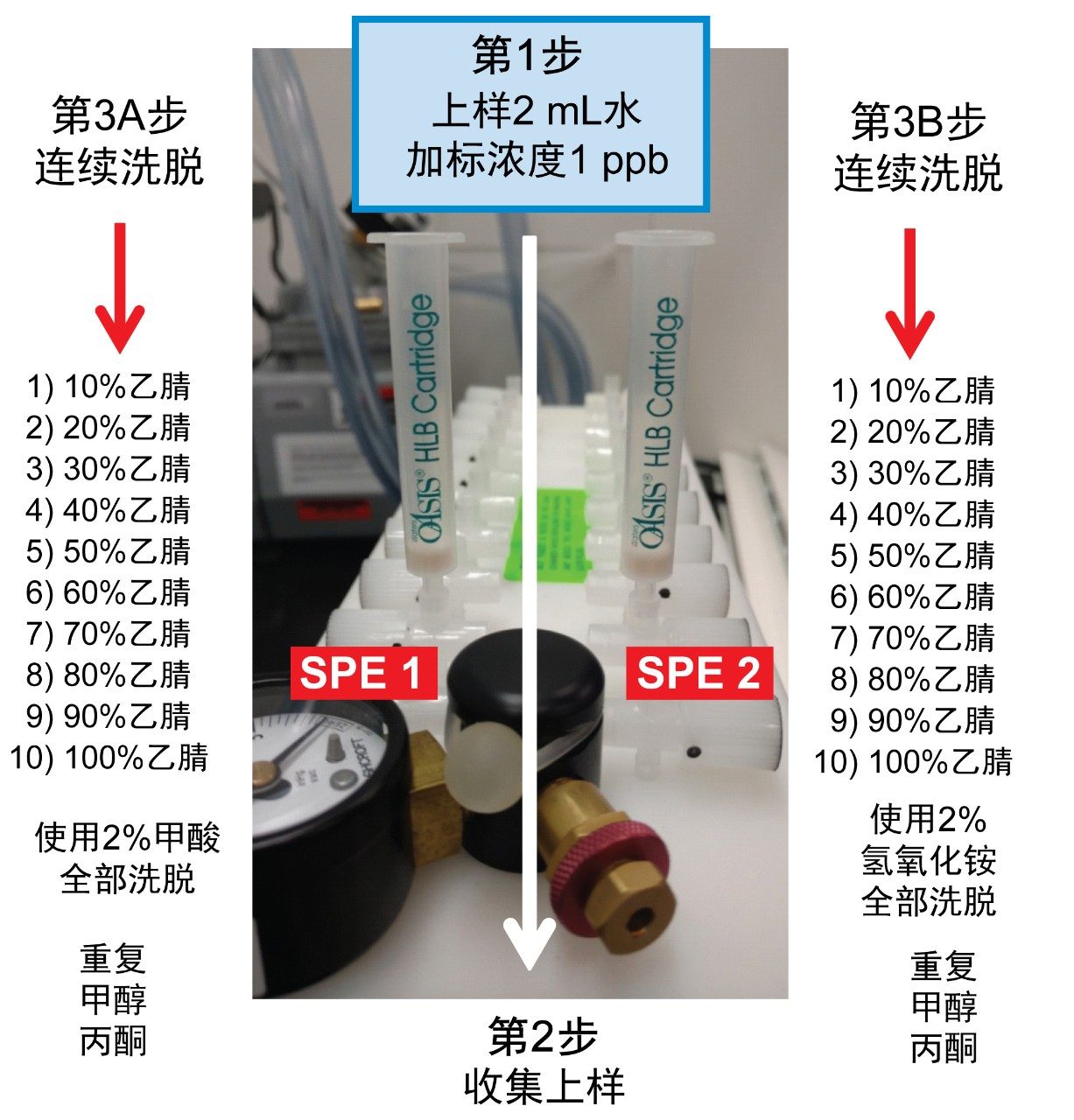
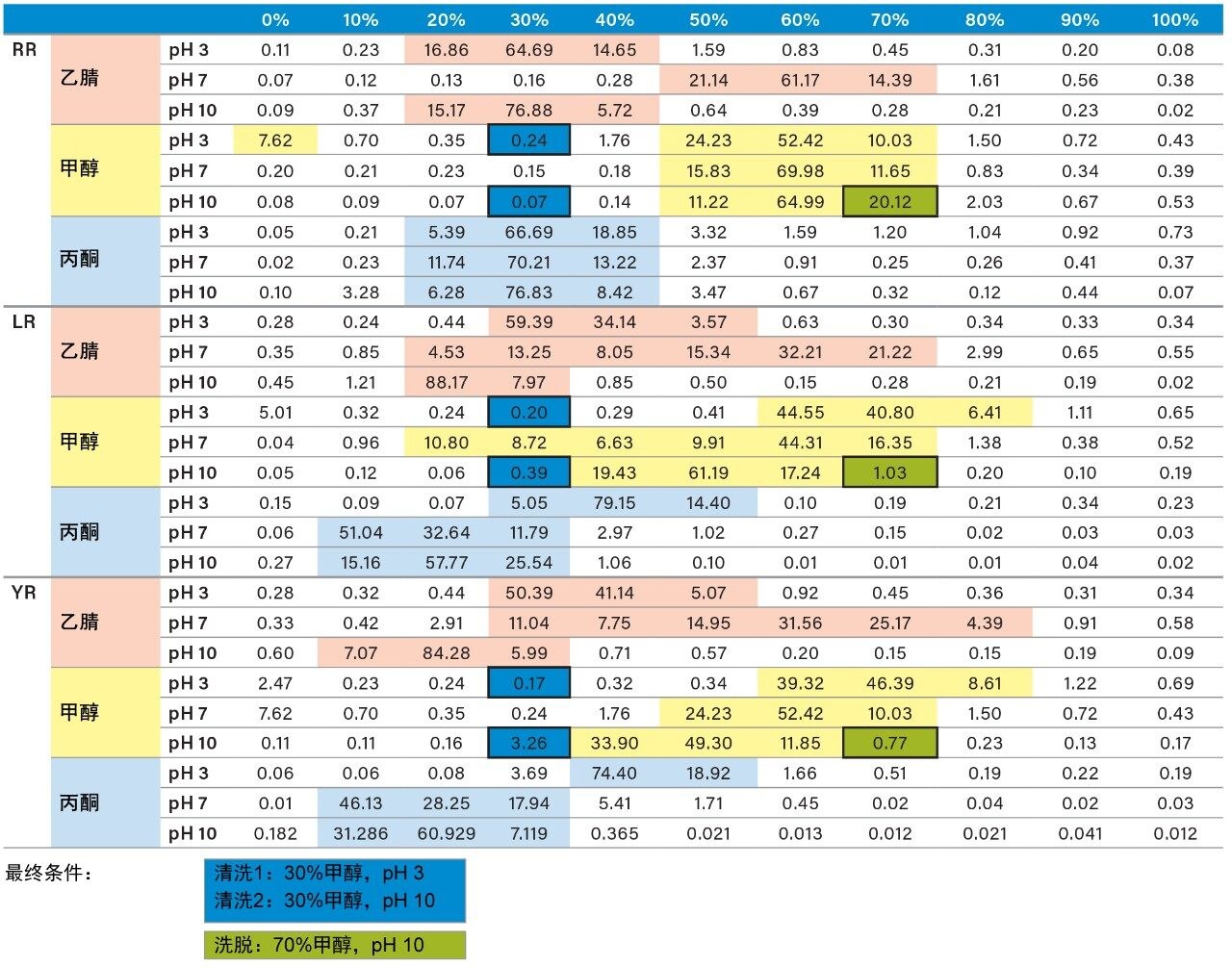
完成LC和MS优化阶段后,接下来的步骤将集中在样品净化、富集和保留行为上。在本例中,以样品制备浓度绘制保留行为图,可以得到更洁净的提取物。该策略依赖于根据目标分析物的pKa和溶解度确定关键洗脱点(回收率0~100%)。图6展示了三步法连续洗脱过程,采用了三种洗脱强度和两个pH值。该实验流程利用两根SPE小柱,在pH 3和10下,三种洗脱溶剂(甲醇、乙腈和丙酮)以10%的洗脱增量从0%增至100%。各洗脱馏分均利用2D-LC捕集柱进行分析,并用ACD系统进行洗脱,而无需进行溶剂蒸发和复溶步骤。结果列于表2中。使用pH 3和10的原因是,微囊藻毒素的保留行为可依据其pKa值了解。例如,在中性洗脱条件下,预计会得到较高的k'值,因此在离子化条件下,要使目标分析物从萃取吸附剂中完全释放出来,需要采用更高比例的有机物,反之亦然。如果目标分析物由碱性部分组成,这种分离行为就很合适。对于微囊藻毒素RR,在pH 3的条件下用乙腈洗脱时,分析物在20%~40%之间被完全洗脱,其中大部分分析物在30%下被洗脱。但在pH 10的条件下,RR在20%~30%之间仅洗脱出极少馏分。这一结果表明,RR为酸性物质(在pH 3的条件下具有低k',在pH 10的条件下具有高k')。微囊藻毒素LR和YR在低pH和高pH洗脱条件下产生类似的谱图,但洗脱曲线有所不同。在洗脱液百分比更高的情况下丙酮和甲醇可得到同样的pH曲线,因此有助于了解微囊藻毒素的溶解度。
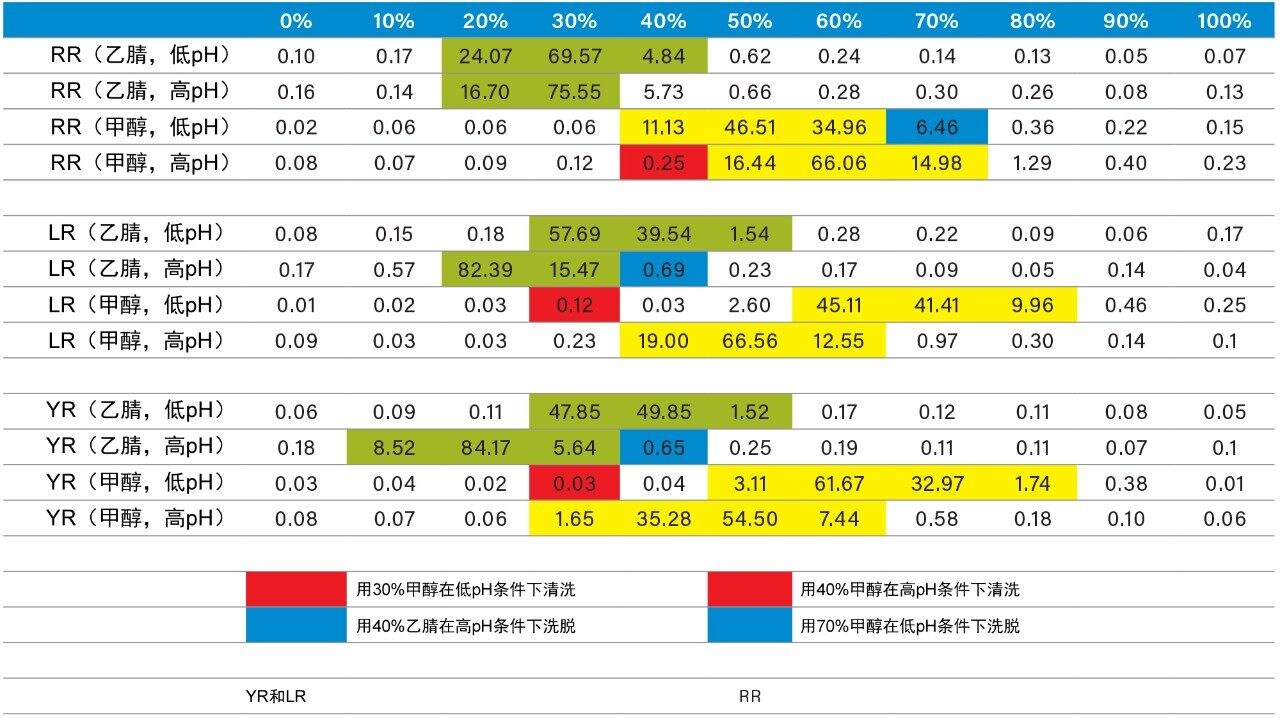
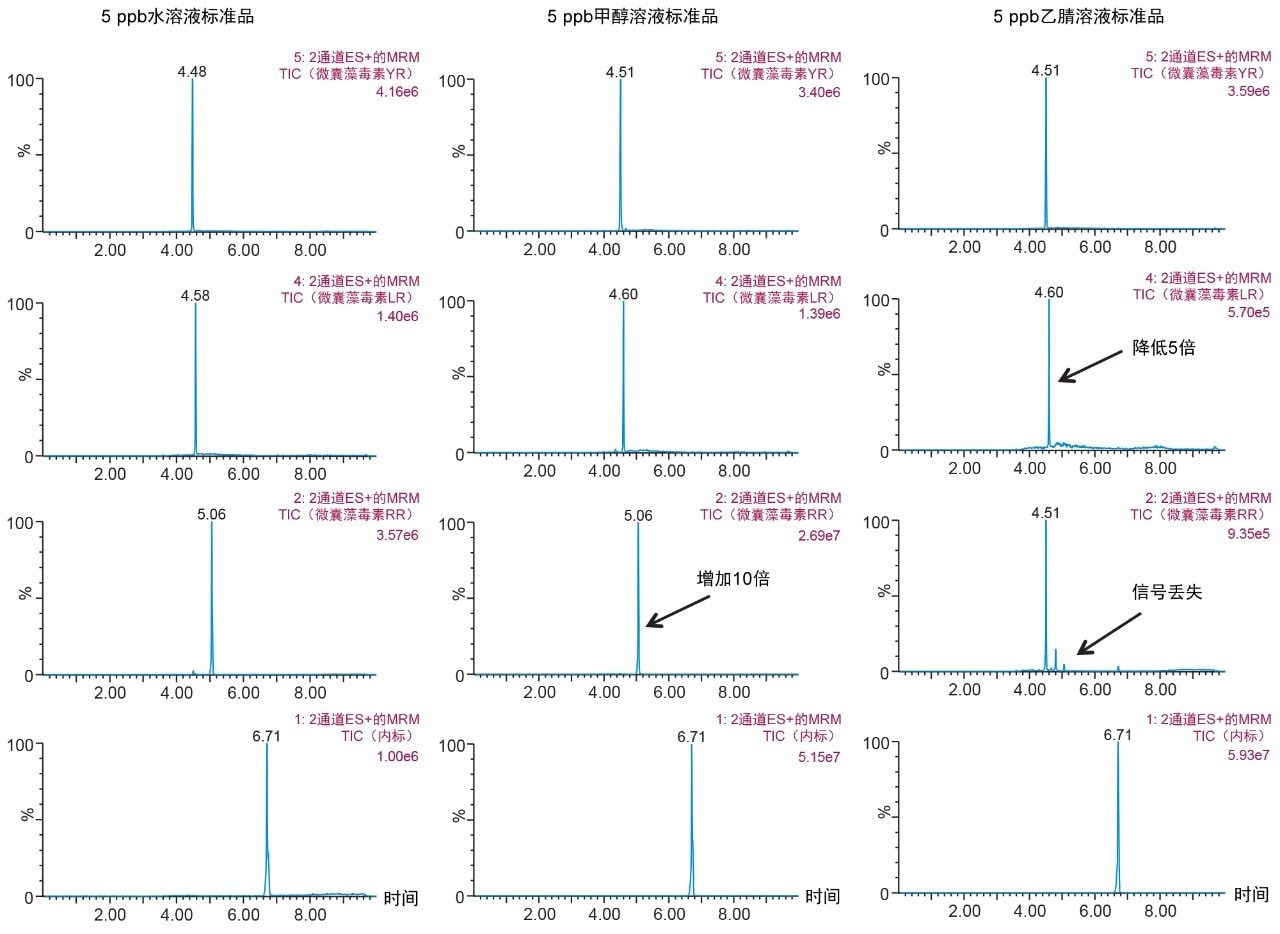
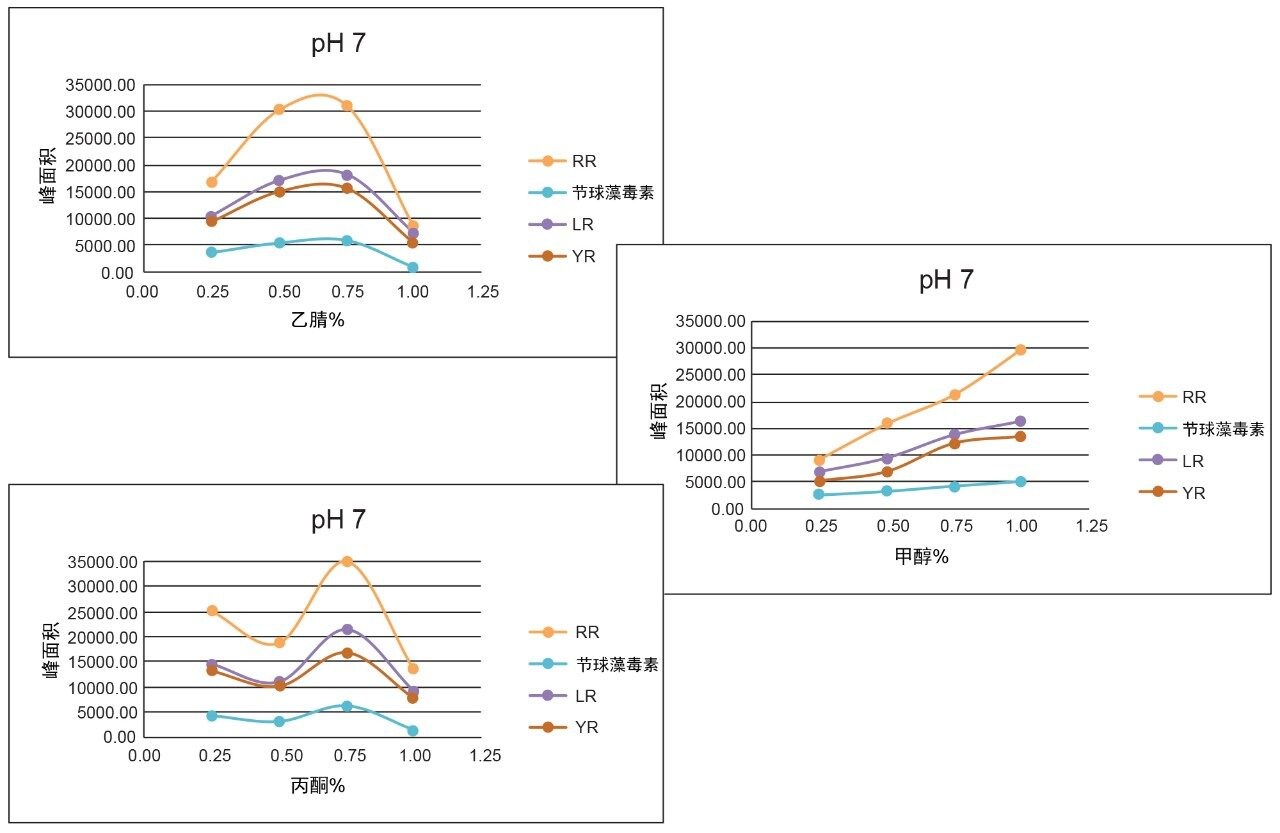
随着工作量增加,在萃取方案的优化过程中发现了差异。图8展示了使用100%水、甲醇和乙腈制备三种YR、LR和RR标准溶液得到的结果。由于微囊藻毒素本质上属于肽类化合物,因此水溶液标准品表现出优异的信号。但在乙腈标准溶液中,RR信号完全消失,LR信号降低50%。由于微囊藻毒素具有肽的性质,因此表现出特有的溶解度趋势12,如图7所示。对于乙腈和丙酮,似乎在有机溶剂百分比较低(<50%)和较高(>75%)时,YR、LR和RR的响应因子会下降,其峰面积减小了50%。这些结果会影响最终的萃取方案。因此,重新评估了表2中列出的洗脱曲线,并在此时增加了第三种溶剂(丙酮)完成研究。表3中的图展示了更新的YR、LR和RR洗脱图。还根据上述结果确定了一种新的萃取方案。
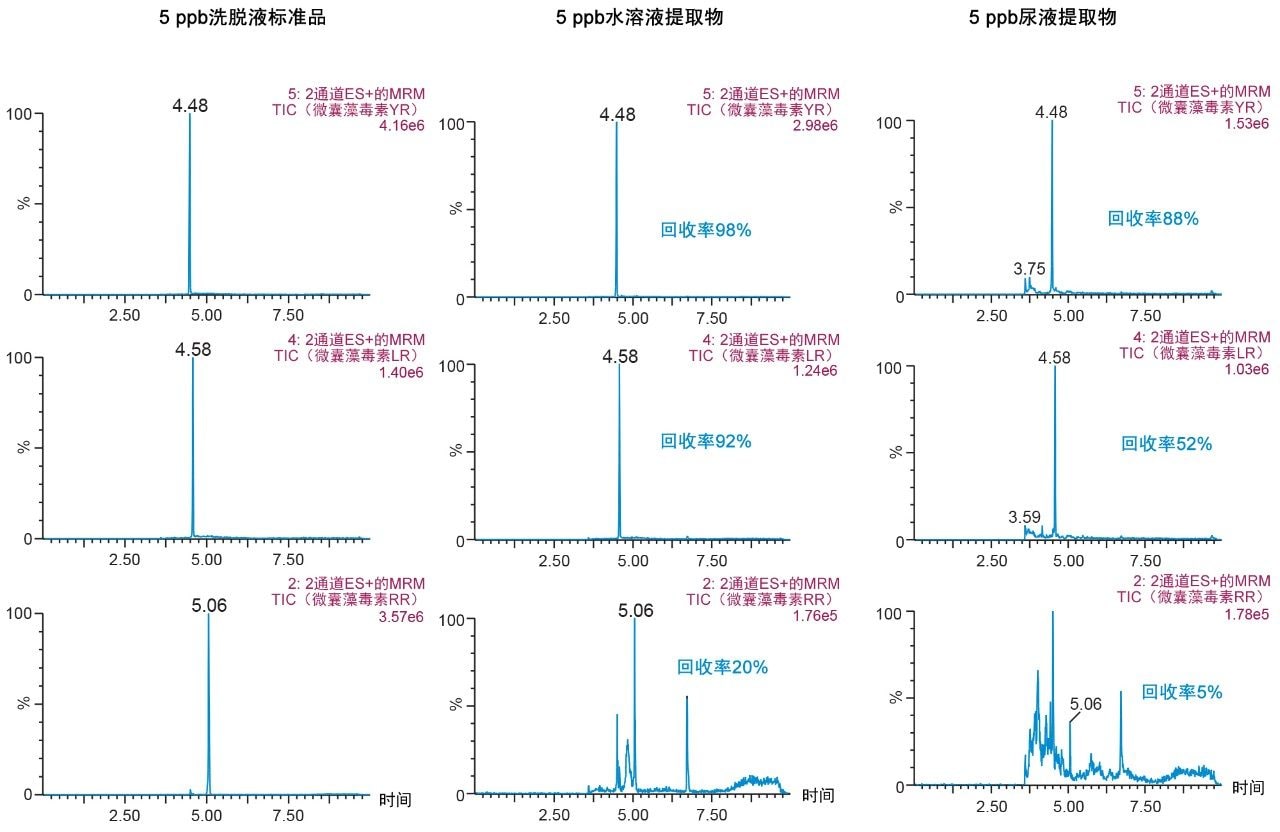
第一种萃取方法在pH 3的条件下用30%甲醇进行清洗,然后在pH 10的条件下用40%乙腈进行洗脱,结果表明(图9),从尿液中提取的RR和LR的回收率极低。这一结果证实了图8所示的趋势,因此选择了一种更新的方法,采用甲醇作为洗脱溶剂,避免萃取过程中的溶解度问题。选择的最终SPE条件包括在pH 3和pH 8的条件下用40%甲醇进行两次清洗步骤,并在pH 10的条件下用70%甲醇进行一次洗脱步骤,可使尿液中的YR、RR和LR获得优异的回收率(图10)。
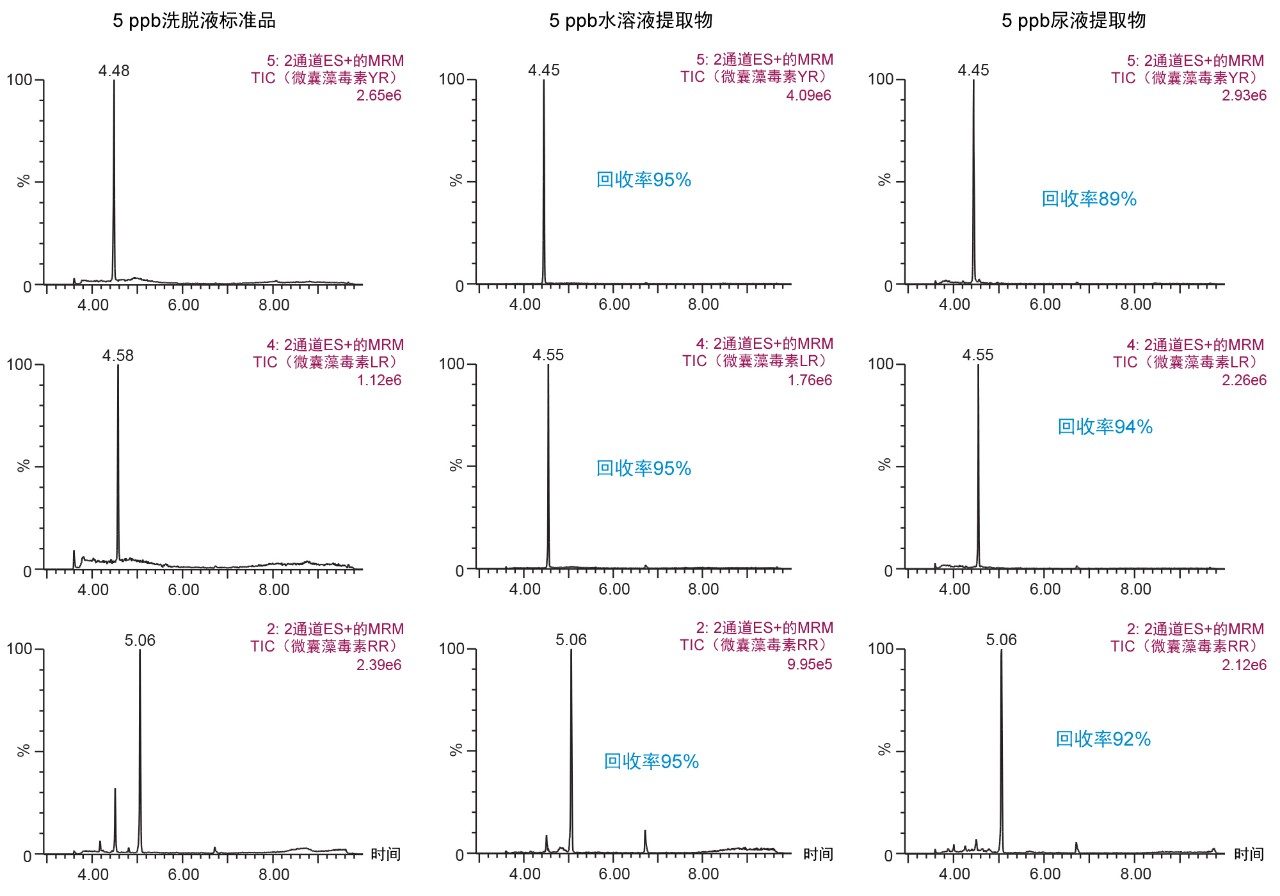
本应用展示了SPE捕获萃取过程在2D-LC-MS/MS分析法分析尿液中微囊藻毒素时的有效性。6 × 6色谱方法优化在大约18 h内完成。选择对含量高达100%的有机提取物直接进行大体积进样可实现萃取方案优化,总工作时间小于30 min。2D-LC-MS/MS的这一额外优势能够直接进样各种百分比的水性和有机提取物,从而有效节省了耗时的蒸发和复溶步骤。捕获萃取方案能够使尿液中微囊藻毒素YR、LR和RR的回收率达到90%。
720006684ZH,2019年10月