本应用纪要展示了BioResolve RP色谱柱与简单的0.1% TFA水/乙腈流动相搭配使用时,能够很好地定量含L-组氨酸和rHSA的制剂缓冲液中的各类蛋白质。
蛋白质定量是蛋白质类药物成分和药物产品检测的基本要求,定量结果通常按280 nm处的紫外吸光度计算。但有时蛋白质制剂缓冲液中的组分会干扰紫外吸光度测定结果。
在本应用纪要中,我们使用BioResolve RP色谱柱在组氨酸缓冲液和重组人血清白蛋白(rHSA)存在的条件下对利妥昔单抗(单克隆抗体)、白介素-12、促红细胞生成素以及阿巴西普(融合蛋白)进行反相LC分离和定量。BioResolve RP色谱柱填料采用2.7 µm高柱效硅胶实心核颗粒,拥有经过优化的450Å孔径和创新聚苯键合相,非常适用于蛋白的分离及相关应用1,2。

用26 mM组氨酸缓冲液(pH 6)将利妥昔单抗、白介素-12、促红细胞生成素和阿巴西普稀释为一系列具有不同浓度的溶液。然后再向各样品中加入恒定浓度(1或2.5 mg/mL)的重组人血清白蛋白(rHSA)。
|
系统: |
ACQUITY UPLC H-Class Bio |
|
系统配置: |
从自动进样器到色谱柱入口: |
|
主动预加热器(APH),MP35N,12.5(部件号:205000756) |
|
|
从色谱柱出口到TUV: |
|
|
管路入口组件,0.0025 ID LT PEEK NUT,8.5"(部件号:700009971) |
|
|
样品温度: |
4 °C |
|
柱温: |
白介素-12、EPO和阿巴西普为60 °C, |
|
利妥昔单抗为80 °C |
|
|
流速: |
0.3 mL/min |
|
0.2 mL/min |
|
|
进样体积: |
10 µL |
|
色谱柱: |
BioResolve RP mAb色谱柱, 450Å, 2.7 µm, 2.1 x 50 mm(部件号:176004156,含色谱柱、完整mAb和亚基参比标准品) |
|
检测: |
配备5 mm钛合金流通池的ACQUITY UPLC TUV检测器,280 nm |
|
样品收集/样品瓶: |
通过LCGC认证的透明玻璃12×32 mm螺纹颈口全回收样品瓶,配有盖子和预切割PTFE/硅胶隔垫,1 mL体积,100个/包(部件号:186000385C) |
|
流动相A: |
0.1% (v/v)三氟乙酸(TFA) |
|
流动相B: |
0.1% (v/v)三氟乙酸(TFA) |
|
数据管理: |
Empower 3软件 |
|
时间 |
流速(mL/min) |
%A |
%B |
曲线 |
|---|---|---|---|---|
|
0.00 |
0.3 |
61 |
39 |
- |
|
0.50 |
0.3 |
61 |
39 |
6 |
|
3.00 |
0.3 |
42 |
58 |
6 |
|
4.00 |
0.3 |
10 |
90 |
6 |
|
4.01 |
0.3 |
61 |
39 |
11 |
|
15.00 |
0.0 |
61 |
39 |
11 |
|
时间 |
流速(mL/min) |
%A |
%B |
曲线 |
|---|---|---|---|---|
|
0.000 |
1.8 |
65 |
35 |
- |
|
0.083 |
1.8 |
65 |
35 |
6 |
|
0.500 |
1.8 |
45 |
55 |
6 |
|
0.650 |
1.8 |
10 |
90 |
6 |
|
0.660 |
1.8 |
65 |
35 |
11 |
|
5.000 |
0.0 |
65 |
35 |
11 |
|
时间 |
流速(mL/min) |
%A |
%B |
曲线 |
|---|---|---|---|---|
|
0.00 |
0.3 |
63 |
37 |
- |
|
0.50 |
0.3 |
63 |
37 |
6 |
|
3.00 |
0.3 |
40 |
60 |
6 |
|
4.00 |
0.3 |
10 |
90 |
6 |
|
4.01 |
0.3 |
63 |
37 |
11 |
|
15.00 |
0.0 |
63 |
37 |
11 |
|
时间 |
流速(mL/min) |
%A |
%B |
曲线 |
|---|---|---|---|---|
|
0.00 |
0.2 |
60.5 |
39.5 |
- |
|
0.50 |
0.2 |
60.5 |
39.5 |
6 |
|
3.00 |
0.2 |
53.0 |
47.0 |
6 |
|
4.00 |
0.2 |
10.0 |
90.0 |
6 |
|
4.01 |
0.2 |
60.5 |
39.5 |
11 |
|
15.00 |
0.0 |
60.5 |
39.5 |
11 |
|
时间 |
流速(mL/min) |
%A |
%B |
曲线 |
|---|---|---|---|---|
|
0.00 |
0.3 |
62 |
38 |
- |
|
0.50 |
0.3 |
62 |
38 |
6 |
|
5.50 |
0.3 |
57 |
43 |
6 |
|
6.50 |
0.3 |
10 |
90 |
6 |
|
6.51 |
0.3 |
62 |
38 |
11 |
|
15.00 |
0.0 |
62 |
38 |
11 |
蛋白质类药物成分或药物产品通常使用制剂缓冲液进行溶解,其中组氨酸较为常用3。 rHSA也常常在制剂中用作辅料,可提升稳定性并起到载体蛋白的作用4。 本实验专门向蛋白质溶液中加入了L-组氨酸和rHSA以模拟制剂缓冲液。要进行定量,就必须先采用色谱法将蛋白质与组氨酸和rHSA分离。在反相色谱柱上,组氨酸会在死体积时间处峰。因此,需要将蛋白质药物与rHSA分离,并制定校准曲线用于定量(即使不含rHSA仍然有效,rHSA的分子量约为67 KDa)。
白介素-12 (IL-12)是一种重要的免疫调节细胞因子,分子量为70 kDa。已有研究表明IL-12在病毒和细菌感染以及癌症等疾病的治疗过程中发挥着关键作用5。
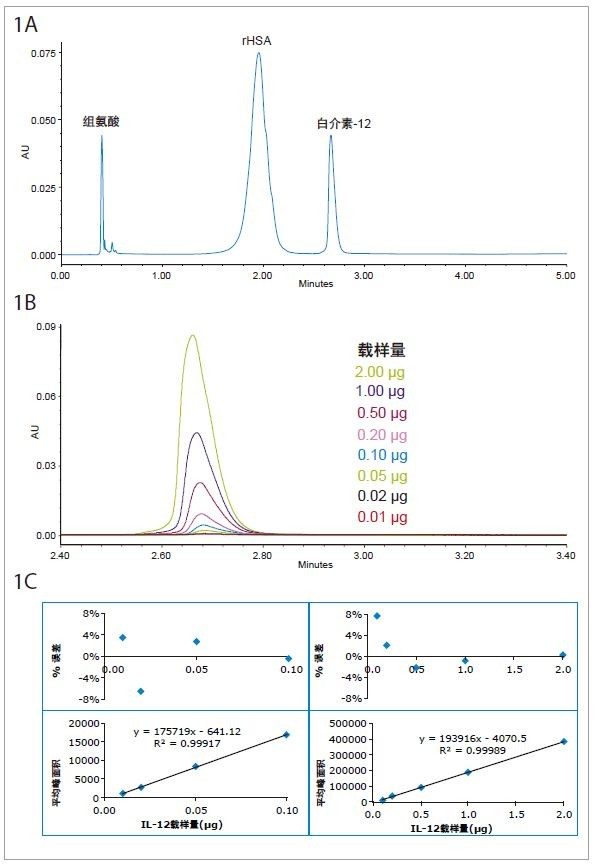
图1A所示为使用BioResolve RP色谱柱在4 min内得的IL-12和rHSA分离结果,其中色谱柱所结合的rHSA与IL-12之间的分离度为3.5。图1B所示为不同浓度IL-12的色谱峰。 根据峰面积制定校准曲线(图1C下方图), 确定的两个线性动态范围为0.01~0.1 μg和0.1~2 μg。根据峰面积(y)和校准曲线的线性方程反算出载样量(x),然后与实验载样量进行比较。%误差的计算方法是:(计算的载样量–实验载样量)/实验载样量 *100%。本研究构建了残差图以展示%误差与载样量的关系(图1c上方图)。在两个线性范围内,所有载样量条件下的%误差均低于8%。
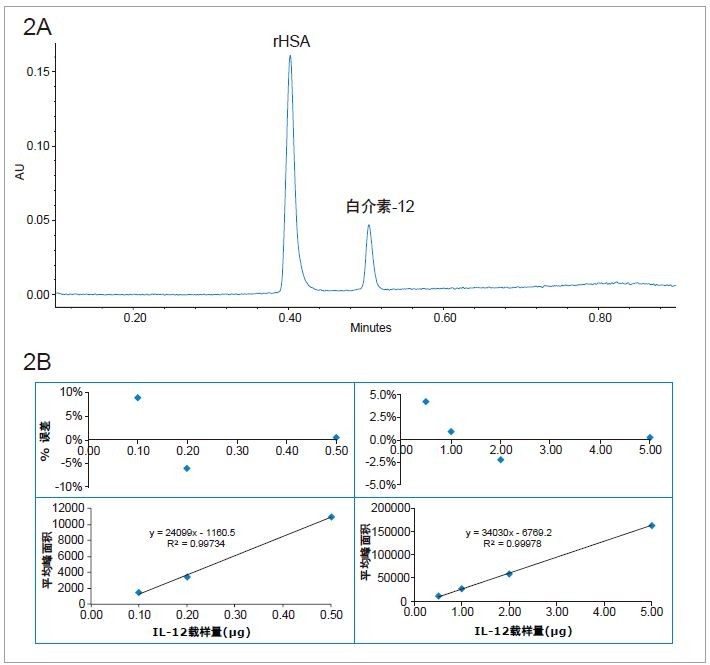
由于BioResolve RP色谱柱的填料为实心核颗粒,因此即使以更高的流速、更快的速度进行分离,也不会影响色谱性能,这得益于上述颗粒出色的传质(动力学)性能。如图2A所示,在流速为1.8 mL/min的条件下,IL-12与rHSA的分离1 min内即已完成,且分离度与流速为0.3 mL/min时相同(梯度斜率不变),数据未展示。图2B所示为校准曲线和残差图,流速为1.8 mL/min。两个线性动态范围内(0.1–0.5 µg和0.5~5 μg),载样量的%误差均在10%以内。上述结果表明,BioResolve RP色谱柱可用于对制剂缓冲液中的蛋白质进行高通量定量。
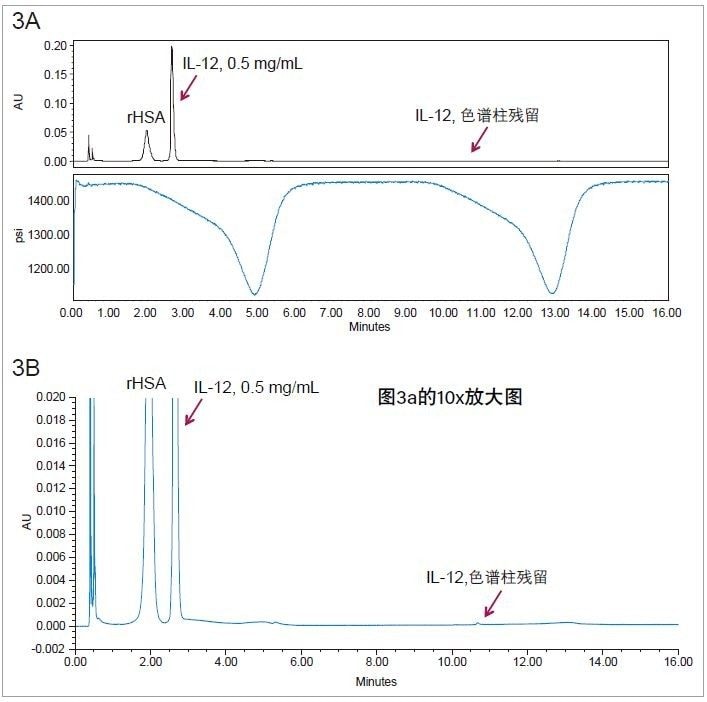
色谱柱的进样间样品残留是大多数反相蛋白质分离的一大难题,会导致定量不准确。BioResolve RP色谱柱设计精良,采用经过专门设计的高覆盖率聚苯键合相,残留极低。利用双梯度测定色谱柱残留,示例如图3A所示。
进样后在第一个梯度过程中分离组分。第一个梯度完成后立即开始第二个梯度,但不再进样。若色谱柱有残留,会看到IL-12在所示保留时间处洗脱出来。计算第二个梯度与第一个梯度的IL-12峰面积比作为色谱柱的残留百分比。图3A中,上方图为色谱图,下方图为压力迹线,箭头所指为残留测定梯度运行过程中IL-12应该洗脱出来的位置。图3B为y轴的放大视图。可以看到保留时间10.6 min处出现了小峰,即为白介素-12色谱柱残留。经计算,色谱柱中的白介素-12残留为0.11%,该结果将线性动态范围限定在大约2~3个数量级。另外还加入了空白样品以扩宽分析的线性动态范围。
因为残留有可能被载体蛋白rHSA所掩盖,原因是载体蛋白对整个色谱柱上的非特异性结合位点可能有阻断作用。但进样纯IL-12时观察到的残留(0.08%)与含有载体蛋白HSA的IL-12相近。
EPO是一种能够刺激患者生成红细胞的生物治疗性糖蛋白,用于治疗肾功能衰竭或癌症治疗所导致的贫血6。 EPO的分子量约为30.4 KDa。
图4所示为使用BioResolve RP色谱柱从rHSA中分离不同浓度EPO得到的色谱图,插图为对应的校准曲线和残差图。EPO与rHSA实现了良好的分离,分离度>5。线性动态范围为0.5~10 µg,R2值为0.9999。载样量%误差在3%以内,并且EPO在色谱柱上无残留。
阿巴西普是一种用于治疗类风湿性关节炎等自身免疫疾病的Fc-融合蛋白7, 其分子量约为90 KDa。
图5所示为从rHSA中分离出的不同浓度阿巴西普的色谱图。虽然未实现基线分离,但线性动态范围(0.2~5 µg)的R2值仍达到了0.9999。载样量%误差在3%以内,且未检出阿巴西普在色谱柱上的残留。
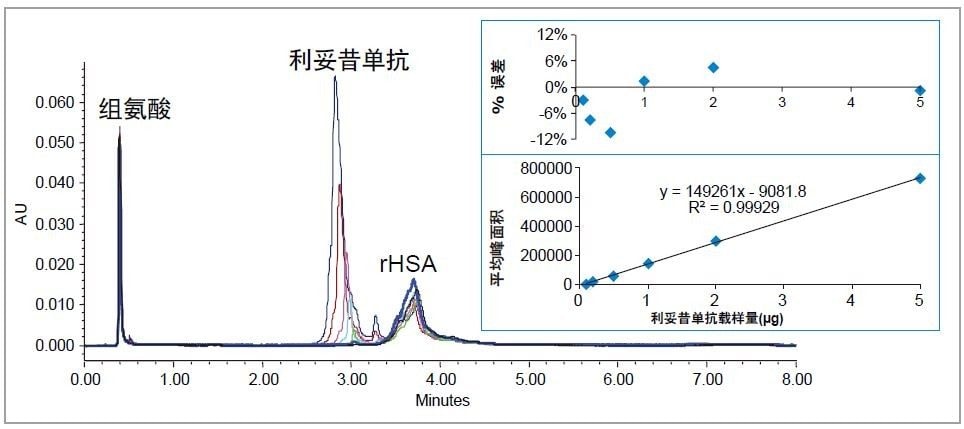
利妥昔单抗是一种能够治疗特定自身免疫疾病及各类癌症的单克隆抗体8, 其分子量约为150 KDa。
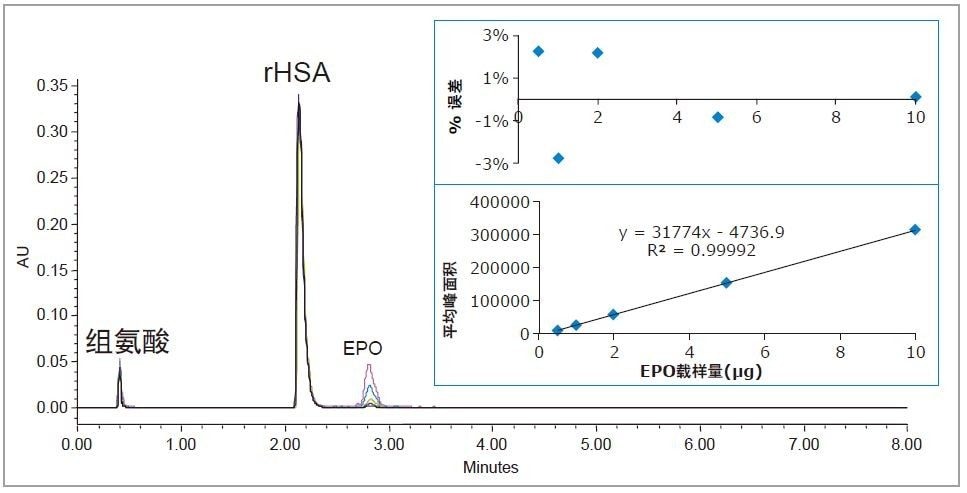
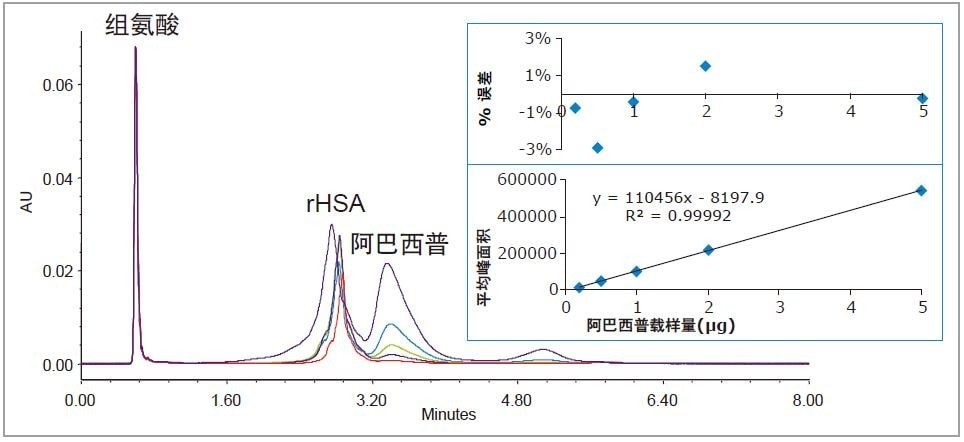
图6所示为从rHSA中分离出的不同浓度利妥昔单抗的色谱图。上述分离过程中,柱温由60 ℃升至80 ℃以确保所进样的利妥昔单抗能够完全回收。每次分离的用时均少于10 min。根据上述数据构建校准曲线,确定线性动态范围为0.1~5 µg,R2 = 0.9993。残差图表明计算载样量的%误差<12%。未检出利妥昔单抗的色谱柱残留。
定量不同生物治疗药物制剂中的蛋白质在药物成分和药物产品检测中至关重要。在某些情况下,制剂缓冲液可能会导致简便的紫外吸光度测定法无法使用,甚至还会遇到通过固定金属亲和色谱(IMAC)法(采用咪唑缓冲液)分析纯化中间体时无法直接使用紫外吸光度测定法定量的情况。在这些情况下,需要使用反相色谱或亲和色谱等分离技术先将药物与干扰紫外吸收的污染物分离,再进行准确定量。
在本应用纪要中,我们展示了BioResolve RP色谱柱与简单的0.1% TFA水/乙腈流动相搭配使用时,能够很好地定量含L-组氨酸和rHSA的制剂缓冲液中的各类蛋白质。使用本文所示方法能够得到优异的线性、较低的误差以及良好的动态范围,且进样间色谱柱的样品残留极低,因此该方法可用于常规的高通量分析。
720006233ZH,2018年3月