在本应用纪要中,我们使用四种样品萃取方案(蛋白沉淀法、Oasis MCX、Oasis PRiME MCX 3步方案和Oasis PRiME MCX 4步方案)对三种药物进行分析,比较了这四种方法的回收率和基质效应(包括磷脂去除率)。
生物分析在药物发现和开发中发挥着重要作用,其中样品制备是获得可靠结果的关键步骤1。 为实验室开发高通量分析方法时,分析速度、方法稳定性和成本是必须考虑的重要因素。
Oasis PRiME MCX是一款混合模式/强阳离子交换固相萃取(SPE)产品,相较于其它样品制备技术,该产品可通过去除磷脂萃取出更洁净的碱性化合物。在本应用纪要中,我们使用96孔µElution板,通过快速的3步和4步方案(省去了传统固相萃取法(SPE)的活化和平衡步骤)成功萃取了人血浆中的分析物。
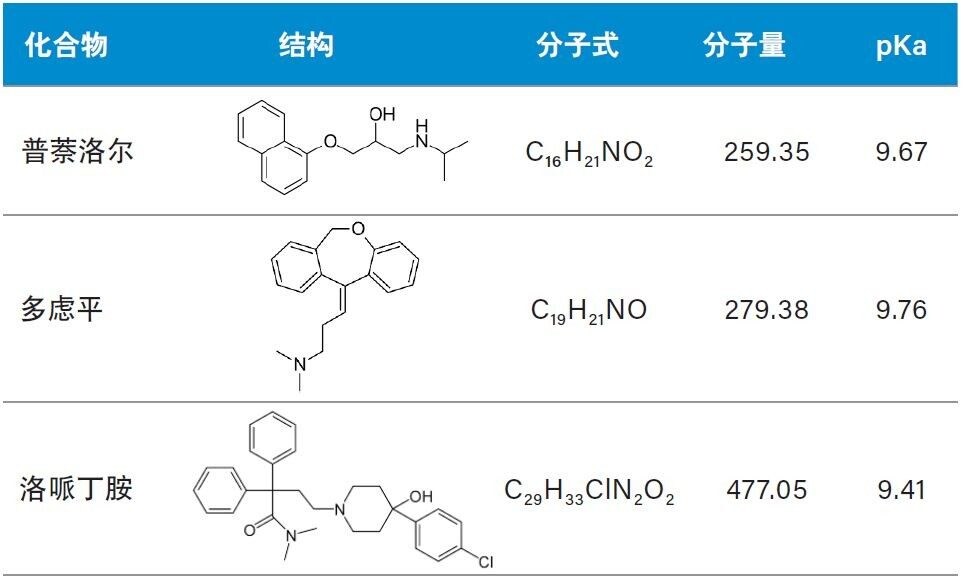
普萘洛尔、多虑平和洛哌丁胺的结构和性质如表1所示。这些分析物的分子量较小且pKa在9.41~9.76范围内,因此适合采用反相色谱进行分离,并通过电喷雾阳离子质谱进行检测。pKa较高也意味着这些药物适合采用阳离子交换吸附剂进行样品制备。
在本应用纪要中,我们使用四种样品萃取方案(蛋白沉淀法、Oasis MCX、Oasis PRiME MCX 3步方案和Oasis PRiME MCX 4步方案)对三种药物进行分析,比较了这四种方法的回收率和基质效应(包括磷脂去除率)。
将普萘洛尔、多虑平和洛哌丁胺(Sigma Aldrich,英国多塞特郡)加标至混合人血浆(Sera Laboratories,英国西萨塞克斯郡)中,制得浓度在1.0~100 ng/mL范围内的加标样品。另外,自制浓度为7.5、30和75 ng/mL(分别代表低、中、高QC浓度)的质控(QC)样品。
1.蛋白沉淀法
将血浆样品/QC样品(100 µL)转移到有刻度的微量离心管中。加入甲醇(300 µL)使蛋白质沉淀。离心管加盖涡旋30 s,然后在13000 rpm的转速下离心5 min。
2.Oasis MCX
将血浆样品/QC样品(100 µL)转移到有刻度的微量离心管中。向样品中加入4%磷酸(100 µL),以破坏蛋白质结合,同时使分析物质子化,促进离子交换相互作用。离心管加盖涡旋30 s,然后在13000 rpm的转速下离心5 min。将上清液转移至已经过甲醇活化并用水进行了平衡的96孔Oasis MCX μElution板中。依次用2%甲酸水溶液和100%甲醇清洗萃取板。然后用5%的氨化甲醇溶液(25 µL)洗脱2次,再用水(50 µL)洗脱。
在分析之前,将样品板密封并轻轻涡旋30 s。
3.Oasis PRiME MCX(4步方案)
将血浆样品/QC样品(100 µL)转移到有刻度的微量离心管中。向离心管中加入4%磷酸(100 µL),以破坏蛋白质结合,同时使分析物质子化,促进离子交换相互作用。
离心管加盖涡旋30 s,然后在13000 rpm的转速下离心5 min。将上清液移入96孔Oasis PRiME MCX µElution板中,用清洗溶液1(含2%甲酸的100 mM甲酸铵)和清洗溶液2(100%甲醇)进行清洗。然后用5%的氨化甲醇溶液(25 µL)洗脱2次,再用水(50 µL)洗脱。在分析之前,将样品板密封并轻轻涡旋30 s。
固相萃取步骤汇总于图1。
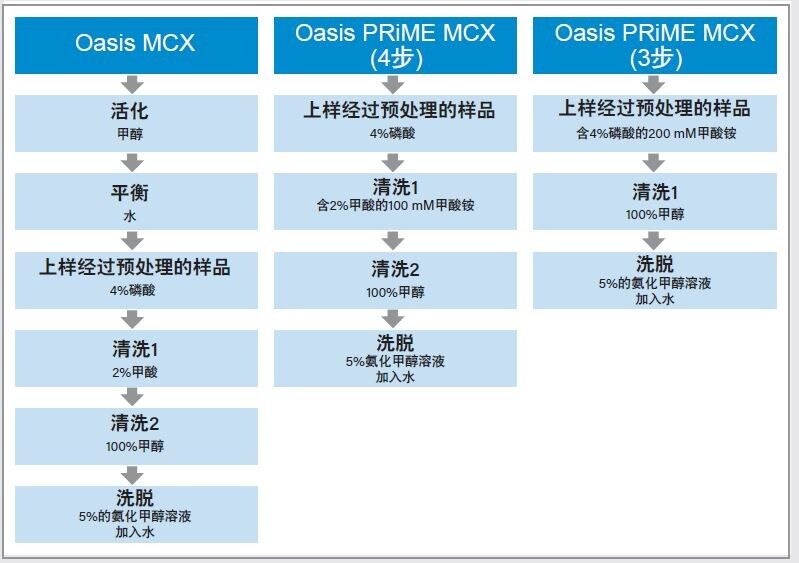
将血浆样品/QC样品(100 µL)转移到有刻度的微量离心管中。向离心管中加入含4%磷酸的200 mM甲酸铵(100 µL),以破坏蛋白质结合,同时使分析物质子化,促进离子交换相互作用。
离心管加盖涡旋30 s,然后在13000 rpm的转速下离心5 min。将上清液移入96孔Oasis PRiME MCX µElution板中,使用100%甲醇进行清洗。然后用5%的氨化甲醇溶液(25 µL)洗脱2次,再用水(50 µL)洗脱。在分析之前,将样品板密封并轻轻涡旋30 s。
|
LC系统: |
ACQUITY UPLC I-Class系统(FTN) |
|
色谱柱: |
ACQUITY UPLC CSH C18 130Å, 1.7 μm, 2.1 x100 mm(部件号186005297) |
|
流动相A: |
0.1%甲酸的水溶液 |
|
流动相B: |
甲醇 |
|
清洗溶剂: |
80%甲醇水溶液和0.1%甲酸 |
|
清除溶剂: |
20%甲醇水溶液和0.1%甲酸 |
|
密封清洗液: |
20%甲醇水溶液 |
|
柱温: |
45 °C |
|
样品温度: |
10 °C |
|
进样体积: |
10 μL |
|
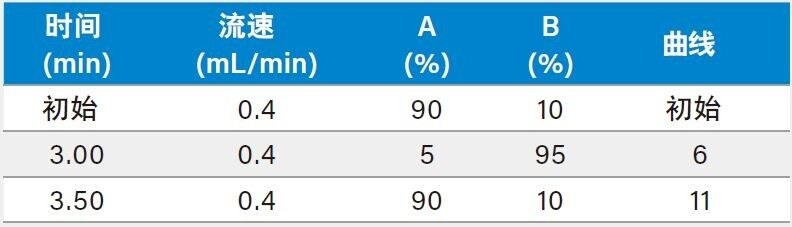
梯度: |
见表2 |
|
运行时间: |
5.0 min(进样之间间隔约5.0 min) |
|
系统: |
Xevo TQD |
|
分辨率: |
MS1和MS2 (0.75 FWHM) |
|
采集模式: |
多重反应监测(MRM)(详见表3) |
|
极性: |
ESI正离子模式 |
|
毛细管电压: |
1.0 kV |
|
锥孔电压: |
见表3 |
|
离子源温度: |
150 °C |
|
脱溶剂气温度: |
600 °C |
|
脱溶剂气流速: |
1000 L/h |
|
锥孔气体流速: |
100 L/h |
|
驻留时间: |
0.02 s |
|
扫描间延迟时间: |
0.02 s |
|
通道间延迟时间: |
0.01 s |
带XS应用软件的MassLynx 4.1版。
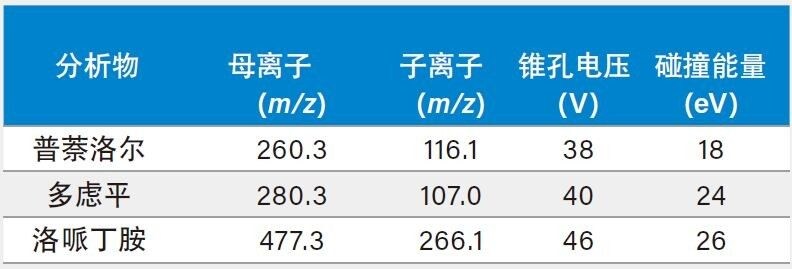
分析代表了整个浓度范围的三个QC样品,每个样品重复分析6次,以确定蛋白沉淀法、Oasis MCX、Oasis PRiME MCX 4步方案和Oasis PRiME MCX 3步方案的样品萃取回收率。使用如下公式计算萃取回收率:
回收率 (%) = (响应 萃取前加标的样品 / 响应 萃取后加标的样品) x 100
三种分析物的结果表明,Oasis PRiME MCX(3步方案)、Oasis PRiME MCX(4步方案)和Oasis MCX都获得了良好的萃取回收率(总体平均回收率%为81.2~99.1)和精度(%RSD范围为3.1~9.3)。蛋白沉淀法也获得了良好的精度(%RSD范围为7.8~8.6),但其%回收率比任何一种Oasis MCX样品制备方案都低(总体平均%回收率为30.7~32.1)(表4)。
分析代表了整个浓度范围的三个样品,每个样品重复分析6次,以确定蛋白沉淀法、Oasis MCX和Oasis PRiME MCX样品萃取方案的基质效应。使用如下公式计算基质效应:
基质效应 (%) = ( (响应 萃取后加标的样品 / 响应 无基质) -1 ) x 100
存在基质时的峰面积是指在萃取之后加入分析物制得的萃取基质样品的峰面积。无基质时的峰面积是指溶于溶剂中的分析物的峰面积。
使用蛋白沉淀法时,观察到显著的基质效应;平均基质效应为-51.6%(在-47.8%~-54.5%范围内),这表示存在严重的离子抑制。采用混合模式强阳离子交换固相萃取方案时,基质效应降低,Oasis MCX的平均基质效应为-17.2%(在-15.3%~-18.4%范围内)。采用Oasis PRiME MCX(4步方案)和Oasis PRiME MCX(3步方案)时,平均基质效应进一步降至10%以下,Oasis PRiME MCX(4步方案)的平均基质效应为-7.8%(在-5.6%~11.0%范围内),Oasis PRiME MCX(3步方案)的平均基质效应为-6.9%(在-3.7%~-10.4%范围内)。
为了评估磷脂去除率,我们进行了母离子扫描实验,对四种萃取方案所得的血浆样品萃取物中m/z 184离子的母离子进行监测。以磷脂含量最高的蛋白沉淀法萃取物为基准,对磷脂峰面积进行归一化处理。图2清楚地表明,Oasis PRiME MCX方案相较于蛋白沉淀法去除了多达98%的磷脂,同样与蛋白沉淀法相比较,Oasis MCX也成功去除了多达86%的磷脂。
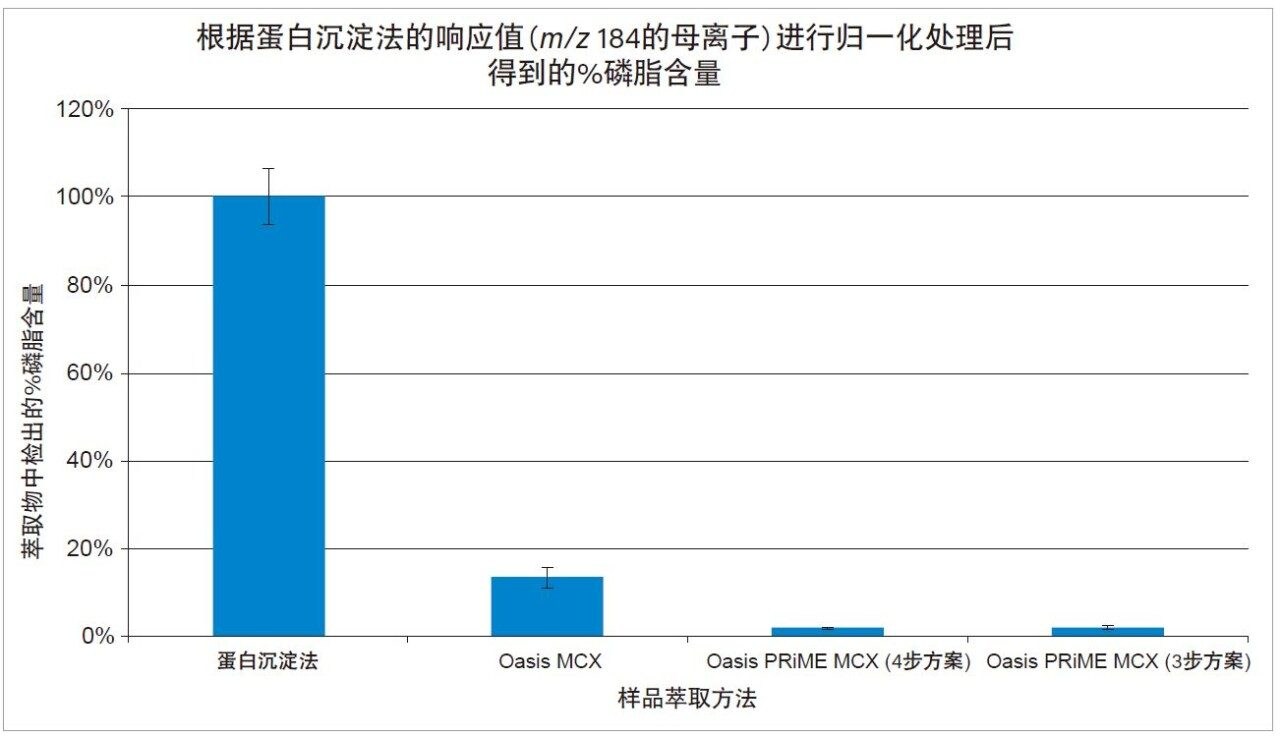
与蛋白沉淀法相比,Oasis PRiME MCX(3步)和Oasis PRiME MCX(4步)样品制备方案可去除98%的磷脂,而且结果重现性优异,所得萃取物更纯净(基质效应小于-10%)。这两种方案是对只能去除86.6%的磷脂的Oasis MCX方案的改进,但在精度和回收率上Oasis MCX与Oasis PRiME MCX方案相当,基质效应为-17.2%。
尽管蛋白沉淀法是一种低成本的样品制备方法,但该方法的基质效应显著,因此样品净化效率可能较差(回收率低、基质效应高),进而会影响生物分析方法的稳定性。
使用µElution板配合精简的Oasis PRiME MCX方案所得的血浆萃取物无需蒸发和复溶即可直接进样分析,为分析人员提供了一个快速的工作流程。该方法采用SPE规格的装置和萃取方案,可使用自动化液体处理设备轻松实现自动化,从而改进实验室工作流程,消除人为操作错误并实现样品追踪功能。
720006202ZH,2018年1月