本应用纪要展示了BioResolve RP色谱柱特有固定相的优势。沃特世专为BioResolve RP色谱柱开发了聚苯键合相,旨在提升mAb和mAb亚基RPLC分离的整体质量,从而挖掘更多有关蛋白治疗药物微异质性的信息。这种精心设计的键合相具有高覆盖率苯基填料的出众优势,因此蛋白质分离能力令人瞩目。BioResolve RP色谱柱不仅选择性优于其他固定相,而且在使用多种离子对试剂的条件下均可提高峰容量。此外,得益于键合覆盖率高的固有特性,聚苯填料的酸稳定性很出色,这有助于减少残留,从而能在温度更低和离子对试剂更弱的条件下完成分离。综上,BioResolve RP色谱柱的新型键合相可协助色谱工作者改善分离度,以及探索温度更低、MS兼容性更好的色谱条件。
蛋白质固有的复杂性和微异质性使其在用作治疗药物时必须得到充分表征,许多单克隆抗体(mAb)也是如此。高效液相色谱是检测蛋白质和肽类治疗药物分子差异时常用的技术。反相液相色谱(RPLC)能够提供高分离度并且适合质谱检测,因此特别有用。然而,面对分子量大且结构复杂的蛋白质,要想实现高效分离并不容易。蛋白质的RPLC分离主要取决于颗粒的表面化学性质,如果颗粒表面与蛋白质位点发生不良相互作用,可能导致峰展宽和高残留1。
近年来,人们提出了新型键合相,作为蛋白质RPLC分离中常用烷基键合相(例如C4和C8)的替代选择。特别是苯基填料在分离单克隆抗体异构体和抗体片段方面表现出优异的选择性,因为它对蛋白质接触提供了更大的键合相表面,并且能够发生π-π相互作用2。 另一种常用于蛋白质分离的填料是聚二乙烯基苯(DVB),这是一种强疏水材料,无硅烷醇活性(在键合硅胶填料中相当显著)。 考虑这两种填料,假设固定相结合经优化的实心核颗粒基质3与DVB聚合物出色的表面填料会得到前景广阔的蛋白质色谱分析方法。
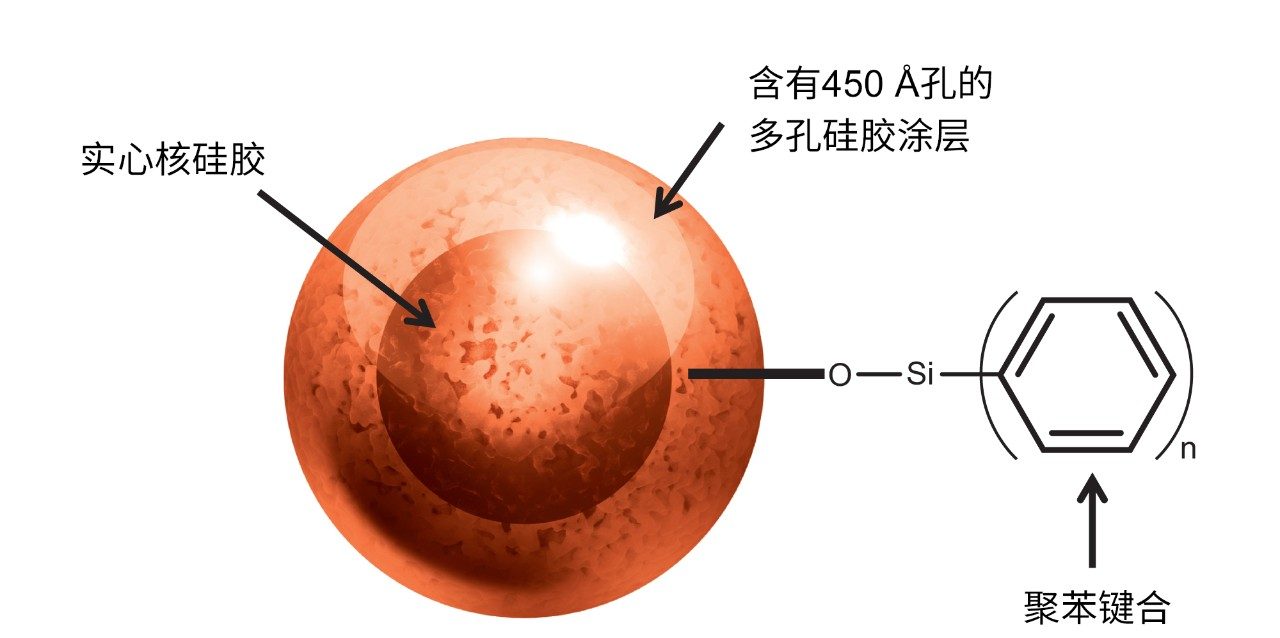
为此,我们开发出一种新型苯基表面填料,凭借多步合成工艺,在优化的450 Å实心核硅胶颗粒上产生独特的高覆盖率键合相(图1)。这种聚苯键合技术不仅覆盖率高(高达6 µmol苯基/m2),而且具有刚性约束碳结构。这些特性结合在一起被认为可大范围地掩蔽硅胶表面,从而限制硅烷醇相互作用。如本文所述,我们认为该键合相可大幅减小蛋白质吸附的构象异质性,发挥更强的保留性以提高分离能力,在较低温度下也能使蛋白质-键合相解吸的离散程度增加。
本应用纪要展示BioResolve RP色谱柱特有固定相的优势,包括有效峰容量高、选择性增加、残留低、酸稳定性出色,与C4和DVB固定相相比对温度和离子对试剂的依赖性更低。
采购还原IdeS酶解NIST mAb,即沃特世mAb亚基标准品(部件号:186008927)。 每瓶标准品包含约25 µg亚基,复溶于100 µL 0.1% (v/v)甲酸(FA)水溶液中。
将10 mg/mL英夫利昔单抗(Remicade)用13 mM磷酸钠缓冲液(pH 7.1)稀释,按照1 µg英夫利昔单抗:1单位IdeS的比例将2 mg/mL浓度的英夫利昔单抗与IdeS在37 °C下温育30 min。将制得的亚基制剂储存于-80 °C下以待分析。
将完整单克隆抗体质量数检查标准品(1 mg,部件号:186006552)的冻干颗粒复溶于500 µL 0.1% (v/v)甲酸水溶液中,浓度为2 mg/mL。
用水制备含有25 µg/mL硫脲、525 µg/mL苯胺、50 µg/mL对羟基苯甲酸甲酯和300 µg/mL苯酚的储备液。
根据BioResolve RP mAb Polyphenyl Column Care and Use Manual(《BioResolve RP色谱柱维护和使用手册》,部件号:720006027EN)中的说明,使用完整单抗质量数检查标准品对所有色谱柱进行活化。
|
仪器: |
ACQUITY UPLC H-Class Bio |
|
数据管理: |
MassLynx v4.1,UNIFI v1.8 |
|
色谱柱: |
BioResolve RP色谱柱, 450 Å, 2.7 μm, 2.1 × 50 mm(部件号:176004156;含色谱柱、完整mAb和亚基标准品) |
|
|
其他色谱柱,2.1 × 50 mm |
|
流动相A: |
0.1% FA或TFA (v/v)的水溶液 |
|
流动相B: |
0.1% FA或TFA (v/v)的乙腈溶液 |
|
梯度: |
测量完整mAb残留效应时,重复使用流动相B在20 min从15%增加至55%的梯度 |
|
流速: |
0.2 mL/min |
|
柱温: |
80 °C |
|
检测(UV): |
280 nm |
|
载样量: |
1 μg |
根据公式1计算有效峰容量(Pc*)。
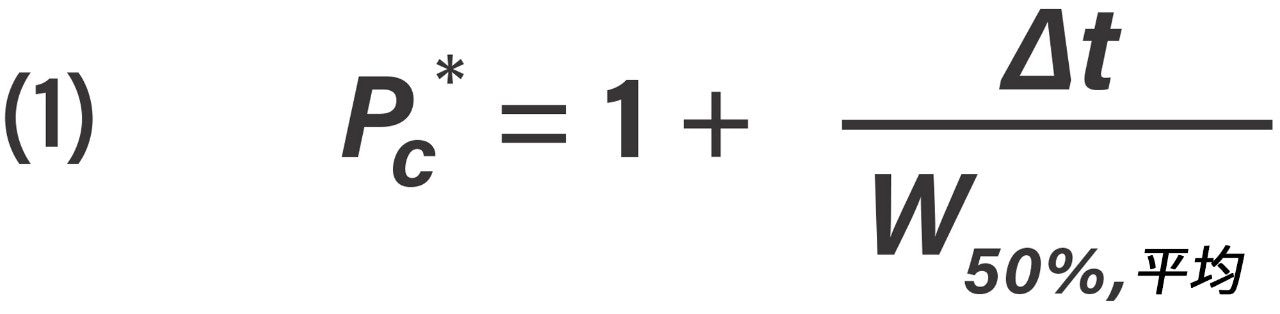
有效峰容量计算公式,其中Δt是第一个洗脱峰与最后一个洗脱峰(分别为英夫利昔单抗的Fc/2和NIST mAb亚基的Fd')的保留时间差,W50%, 平均是所研究分析物的平均半高峰宽。
根据公式2计算残留百分比。
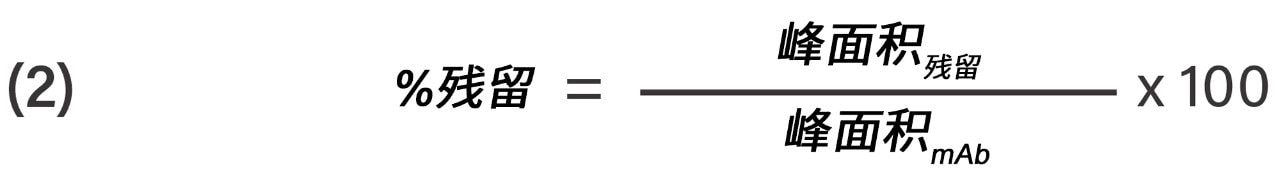
残留百分比计算公式,其中峰面积残留是由双梯度得到的完整mAb的峰面积,峰面积mAb是由第一个梯度得到的完整mAb的峰面积。
|
仪器: |
ACQUITY UPLC H-Class Bio |
|
数据管理: |
Empower 3 FR2 |
|
色谱柱: |
BioResolve RP色谱柱, 450 Å, 2.7 μm, 2.1 × 50 mm(部件号:176004156;含色谱柱、完整mAb和亚基标准品) |
|
|
其他色谱柱,2.1 × 50 mm |
|
流动相: |
0.5% TFA (v/v)水溶液 |
|
洗脱模式: |
等度洗脱 |
|
流速: |
1.40 mL/min |
|
柱温: |
60 °C |
|
检测(UV): |
254 nm |
|
进样体积: |
2 μL |
根据公式3计算对羟基苯甲酸甲酯的保留因子k'。

保留因子计算公式,其中Rt对羟基苯甲酸甲酯是对羟基苯甲酸甲酯的保留时间,Rt硫脲是硫脲的保留时间。
根据公式4计算对羟基苯甲酸甲酯的k'的百分比变化。
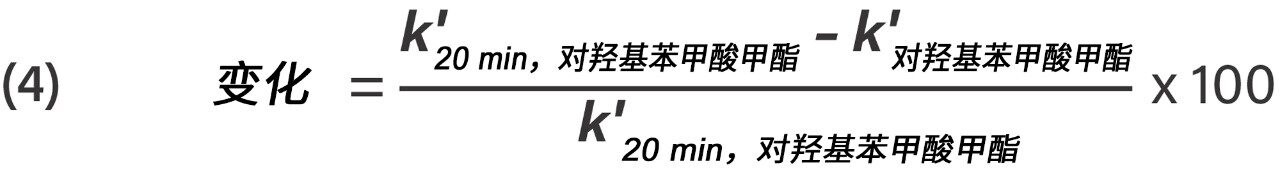
保留因子计算公式,其中k'20 min,对羟基苯甲酸甲酯是对羟基苯甲酸甲酯在20 min暴露时间内的保留因子,k'对羟基苯甲酸甲酯对羟基苯甲酸甲酯在暴露时间超过20 min后的保留因子。
|
仪器: |
ACQUITY UPLC H-Class Bio |
|
数据管理: |
MassLynx v4.1,UNIFI v1.8 |
|
色谱柱: |
BioResolve RP色谱柱, 450 Å, 2.7 μm, 2.1 × 100 mm(部件号:176004156;含色谱柱、完整mAb和亚基标准品) |
|
流动相A: |
0.1% TFA(v/v)水溶液 |
|
流动相B: |
0.1% TFA(v/v)的乙腈溶液 |
|
梯度: |
流动相B在10 min内从15%增加至55% |
|
流速: |
0.8 mL/min |
|
柱温: |
80 °C |
|
检测(UV): |
280 nm |
|
载样量: |
1 μg |
|
仪器: |
ACQUITY UPLC H-Class Bio |
|
数据管理: |
MassLynx v4.1,UNIFI v1.8 |
|
色谱柱: |
BioResolve RP色谱柱, 450 Å, 2.7 μm, 2.1 × 50 mm(部件号:176004156;含色谱柱、完整mAb和亚基标准品) |
|
|
其他色谱柱,2.1 × 50 mm |
|
流动相A: |
0.1% FA、0.02% TFA/0.08% FA或0.1% TFA (v/v)的水溶液 |
|
流动相B: |
0.1% FA、0.02% TFA/0.08% FA或0.1% TFA (v/v)的乙腈溶液 |
|
梯度: |
流动相B在10 min内从15%增加至55% |
|
流速: |
0.4 mL/min |
|
柱温: |
30 °C、40 °C、50 °C、60 °C、70 °C、80 °C或90 °C |
|
检测(UV): |
280 nm |
|
载样量: |
1 μg |
根据公式1计算有效峰容量(Pc*),在本例中,Δt是单独mAb亚基标准品中Fc/2与Fd'组分之间的保留时间差。
|
仪器: |
ACQUITY UPLC H-Class Bio |
|
数据管理: |
MassLynx v4.1,UNIFI v1.8 |
|
色谱柱: |
BioResolve RP色谱柱, 450 Å, 2.7 μm, 2.1 × 150 mm(部件号:176004156;含色谱柱、完整mAb和亚基标准品) |
|
流动相A: |
0.05%或0.1% TFA (v/v)的水溶液 |
|
流动相B: |
0.05%或0.1% TFA (v/v)的乙腈溶液 |
|
梯度: |
流动相B在20 min内从15%增加至55% |
|
流速: |
0.6 mL/min |
|
柱温: |
65 °C或80 °C |
|
检测(UV): |
280 nm |
|
载样量: |
1 μg |
根据公式1计算有效峰容量(Pc*),在本例中,Δt是单独mAb亚基标准品中Fc/2与Fd'组分之间的保留时间差。
为评价聚苯键合相的色谱性能,本研究比较了BioResolve RP色谱柱与几种采用硅胶、杂化和DVB固定相基质颗粒的主要色谱柱。使用多种mAb物质(分子量范围25~150 kDa)来确定色谱柱峰容量。使用添加甲酸(FA)和三氟乙酸(TFA)作为改性剂的流动相分离这些分析物。分离采用内径为2.1 mm的色谱柱,每种分析物的优化载样量为1 µg。由于表面化学性质会影响保留性,因此我们计算了有效峰容量(见公式1)来准确表示分离能力。
图2A展示了使用添加0.1% TFA作为改性剂的流动相所获得的结果。BioResolve RP色谱柱对三种mAb测试样品的平均有效峰容量(Pc,平均*)比其他色谱柱高13%~50%。图2B表明,BioResolve RP色谱柱对每种分析物具有更高的有效峰容量。有趣的是,在这些条件下,ACQUITY UPLC BEH C4, 300 Å蛋白分析专用柱对低分子量分析物(mAb亚基)也表现出优异性能。从这些色谱图可以看出,BioResolve RP色谱柱使多种低丰度物质(例如,mAb亚基Fc/2峰前端的赖氨酸变体)得到部分分离。
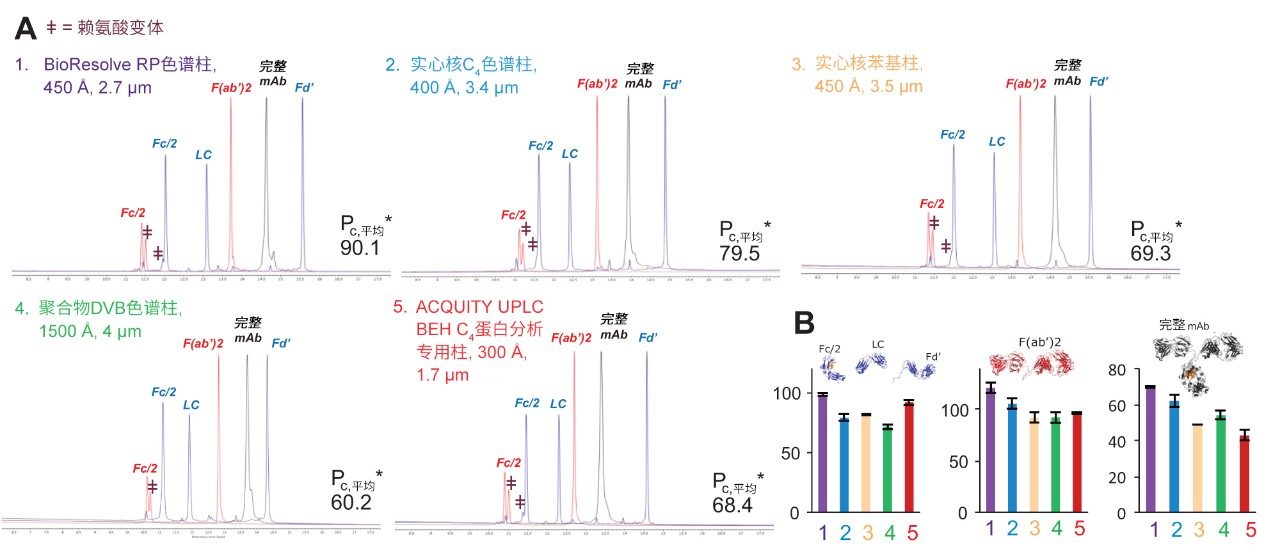
为评估色谱柱对MS兼容条件的适应性,还使用添加0.1% FA作为改性剂的流动相测试了色谱柱性能。由于FA具有弱离子对特性,因此在使用时很难做到不影响分离度和重现性。但它通常是LC-MS分析优先考虑的试剂,因为检测灵敏度高。图3A比较了使用该添加剂得到的同样三个mAb样品的色谱图。BioResolve RP色谱柱在这些条件下表现出理想性能,具体表现为所有Fc/2赖氨酸变体的分离度提高且峰拖尾整体减小。至于使用FA的结果,从图3B可以看出,BioResolve色谱柱提供了最高的平均有效峰容量,并且对各种蛋白质物质具有最高的有效峰容量。
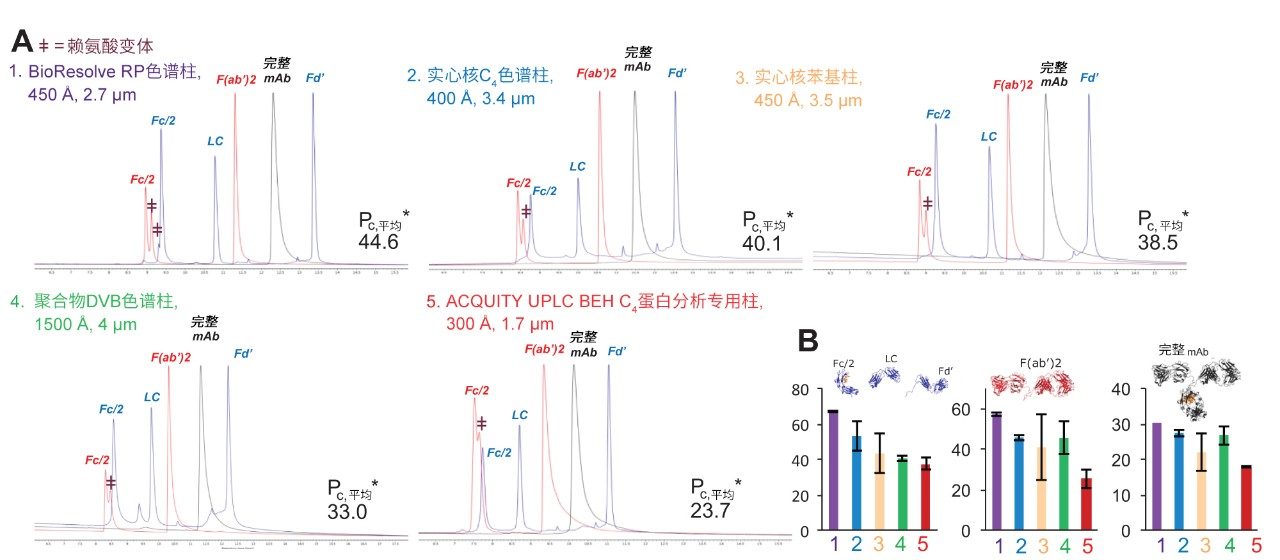
我们认为BioResolve RP色谱柱的优异性能得益于其优化的大孔径实心核颗粒和聚苯键合相。具有刚性约束碳结构、空间体积较大的苯基键合相覆盖率高,可能会限制蛋白质-吸附剂相互作用构象状态的自由度,减弱蛋白质与吸附剂之间的次级相互作用。
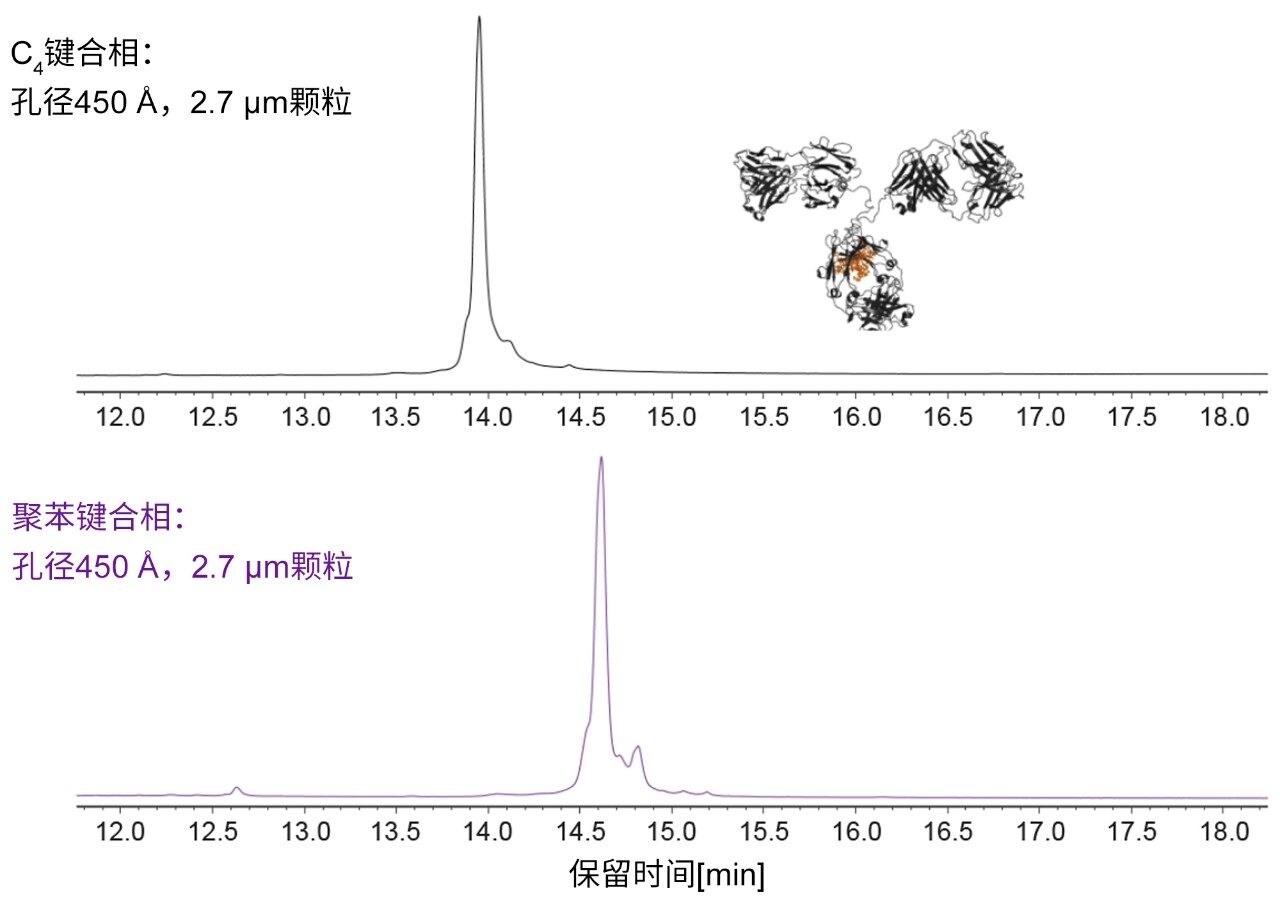
分离度不仅取决于峰锐度,还取决于保留性和选择性。BioResolve RP色谱柱除具有较高的峰容量以外,还表现出选择性优势。图4比较了使用BioResolve RP色谱柱与基于相同颗粒的C4键合原型色谱柱获得的沃特世完整单克隆抗体质量数检查标准品的分离结果。从图中可以明显看出,聚苯色谱柱对标准品中变体的分离效果远胜于C4同类产品。这一观察结果与之前有关苯基键合填料的文献报道一致4。
除优化分离能力外,尽量减少进样间残留也至关重要。当蛋白质从色谱柱上非常缓慢地解吸时,可能发生残留或记忆效应。必须尽量减少残留,以免连续进样之间产生干扰和每次分析的定量结果不准确。为定量残留,在初始梯度下向BioResolve RP色谱柱和四种主要色谱柱(均为2.1 × 50 mm)中注入载样量为1 µg的沃特世完整单克隆抗体质量数检查标准品;初始梯度完成后执行第二次重复梯度,但不进样。这些研究均采用添加TFA和FA作为改性剂的流动相。
图5A显示了在初始梯度下得到的的完整mAb峰,图5B显示了重复梯度对应的的保留窗口(放大50倍),两者均使用添加FA作为改性剂的流动相。图5C中的定量结果表明,在相同的仪器、样品、洗脱液和梯度洗脱条件下,采用BioResolve RP色谱柱在280 nm检测波长下未检测到残留,而基准色谱柱则具有较高的残留水平。当使用添加TFA作为改性剂的流动相时(图5D),这一趋势保持不变:BioResolve RP色谱柱的残留仍低于基准色谱柱。这些残留差异表明,在大幅提高蛋白质解析速率并尽量减小残留效应方面,固定相发挥了主要作用。
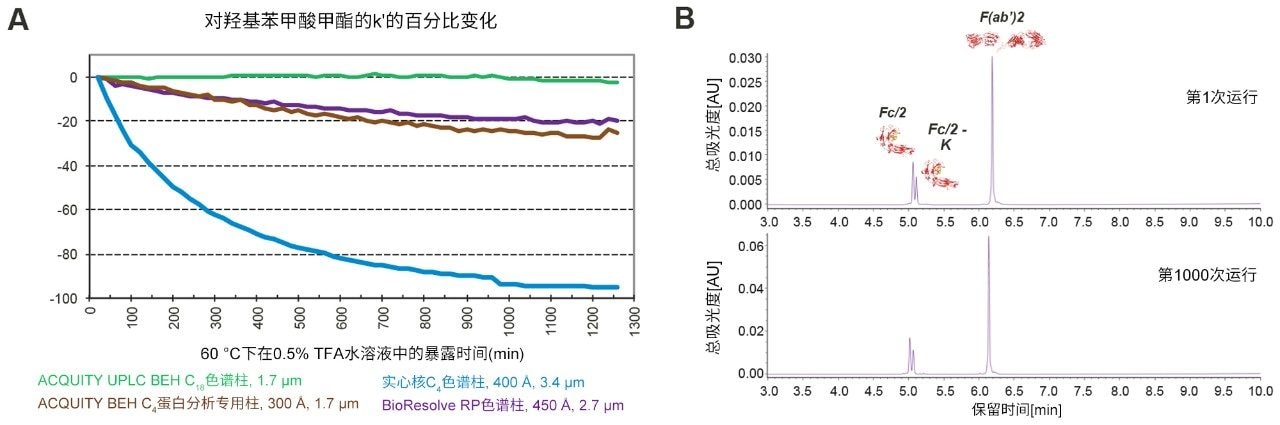
蛋白质反相分离通常在高温下使用酸性离子对流动相。众所周知,这些严苛的分析条件会催化键合相水解,导致色谱性能下降。在加速试验条件下(例如,使用0.5% TFA),可通过分析物保留性的下降轻松监测酸稳定性5。 有一种测试方法将色谱柱暴露于60 °C的0.5% TFA水性流动相中,测定对羟基苯甲酸甲酯的保留因子随时间的变化。通过该测试比较BioResolve RP色谱柱与三种基准色谱柱的酸稳定性。如图6A所示,BioResolve色谱柱与ACQUITY UPLC BEH C4, 300Å蛋白分析专用柱均表现出同样良好的稳定性,在这些恶劣条件下暴露约21 h后,保留性仅降低20%。该结果远远优于n-C4实心核色谱柱,在相同时间内,这些色谱柱上对羟基苯甲酸甲酯的保留几乎消失,表明键合相损失严重。影响酸水解耐受性的因素包括键合相链长、空间体积、键合密度和官能度(通过单键、双键或三键键合硅烷连接)5。 聚苯键合技术旨在提高苯基覆盖率,形成强疏水性表面(尽可能降低水解率)。
在典型条件下测试BioResolve RP色谱柱,连续使用一周后,分离结果的重现性非常好。该测试使用酸性最强的常用流动相(含0.1% TFA)以及80 °C柱温。结果(图6B)表明,运行1000次以后,英夫利昔单抗亚基的分离结果几乎没有变化。色谱性能的定量比较也支持这一观察结果。比较第一次进样与最后一次进样的结果发现,所有亚基的保留时间变化小于1%;在峰宽方面,Fc/2亚基峰实际上变得更尖锐,分别改善了2%和3%。同时,大分子F(ab)'2片段的峰宽仅增加4%。这些结果表明,聚苯键合技术提供了出色的水解稳定性,BioResolve RP色谱柱继而使分析人员能够在长期使用过程中更可靠地重现分离结果。
为蛋白质RPLC分离设计键合相填料时,另一个考虑因素是它们对较高分离温度的依赖性。mAb的反相分离温度一直需要高达80~90 °C。然而,结合强酸性条件时,此类温度可能导致柱上蛋白质降解1。因此,尽可能降低蛋白质RPLC分离温度是有利的。
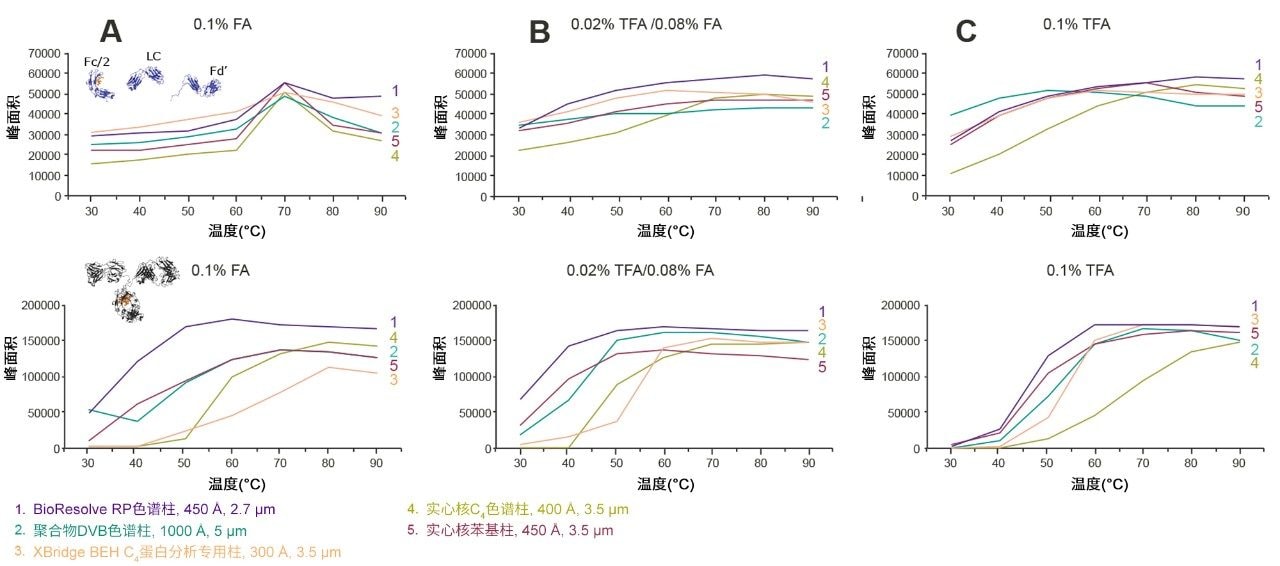
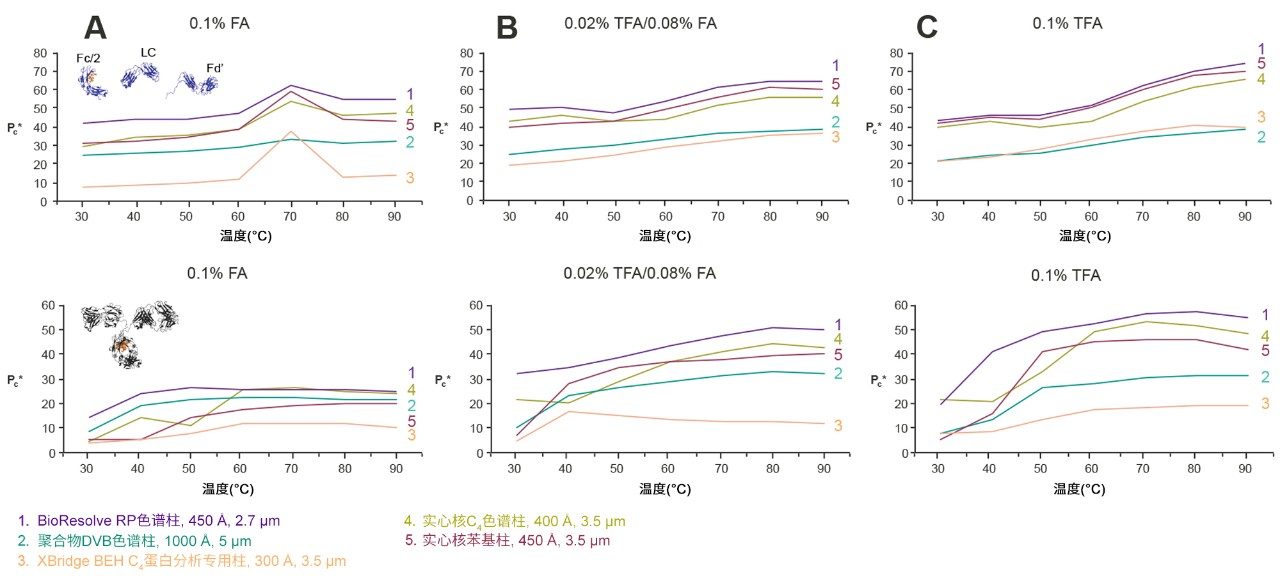
在蛋白质分离中,主要有两个因素会随温度变化:回收率和分离度。使用三种不同的离子对条件(0.1% FA、0.02% TFA/0.08% FA和0.1% TFA),通过mAb亚基标准品和完整单克隆抗体质量数检查标准品测定这些响应随温度的变化。测量峰面积作为回收率的替代指标,使用有效峰容量代表分离度。本研究测试了BioResolve RP色谱柱以及四种基准色谱柱。
研究结果如图7和图8所示。图7中的峰面积结果表明,至少对本研究中考察的两组分析物而言,当离子对条件改变时,回收率的变化程度可能相当大。 在最强的离子对条件(0.1% TFA)下,只要采用非常高的温度,即可获得最高的蛋白质峰面积和峰容量。但是,使用0.02% TFA/0.08% FA也会产生相对较高的峰面积和峰容量。事实上,在较低温度下,较低浓度的TFA被证明是有利的。不过,图7和图8表明,使用0.1% FA时,蛋白质分离对低温的耐受性较差(与0.1% TFA类似),尤其是本例中在低于70 °C的温度下测试的mAb亚基。综上,这些示例表明,蛋白质RPLC分离的温度依赖性与离子对密切相关。
在三种离子对条件下,BioResolve RP色谱柱相比考察的其他色谱柱均提供了更高的回收率,但有例外情况,即聚合物DVB色谱柱在低温下与0.1% TFA配合使用时,对mAb亚基的表现。如图8所示,BioResolve RP色谱柱还表现出实心核颗粒技术固有的动力学优势,使用所有离子对条件在考察的温度范围内均提供了最高的峰容量。因此,BioResolve RP色谱柱可用于50~70 °C的温度范围,还可以采用更适合MS的离子对条件。由此可以同时减少样品和色谱柱的降解。但是,由于蛋白质的复杂性,使用这些替代条件时预计会有一些注意事项,并且结果将取决于样品。
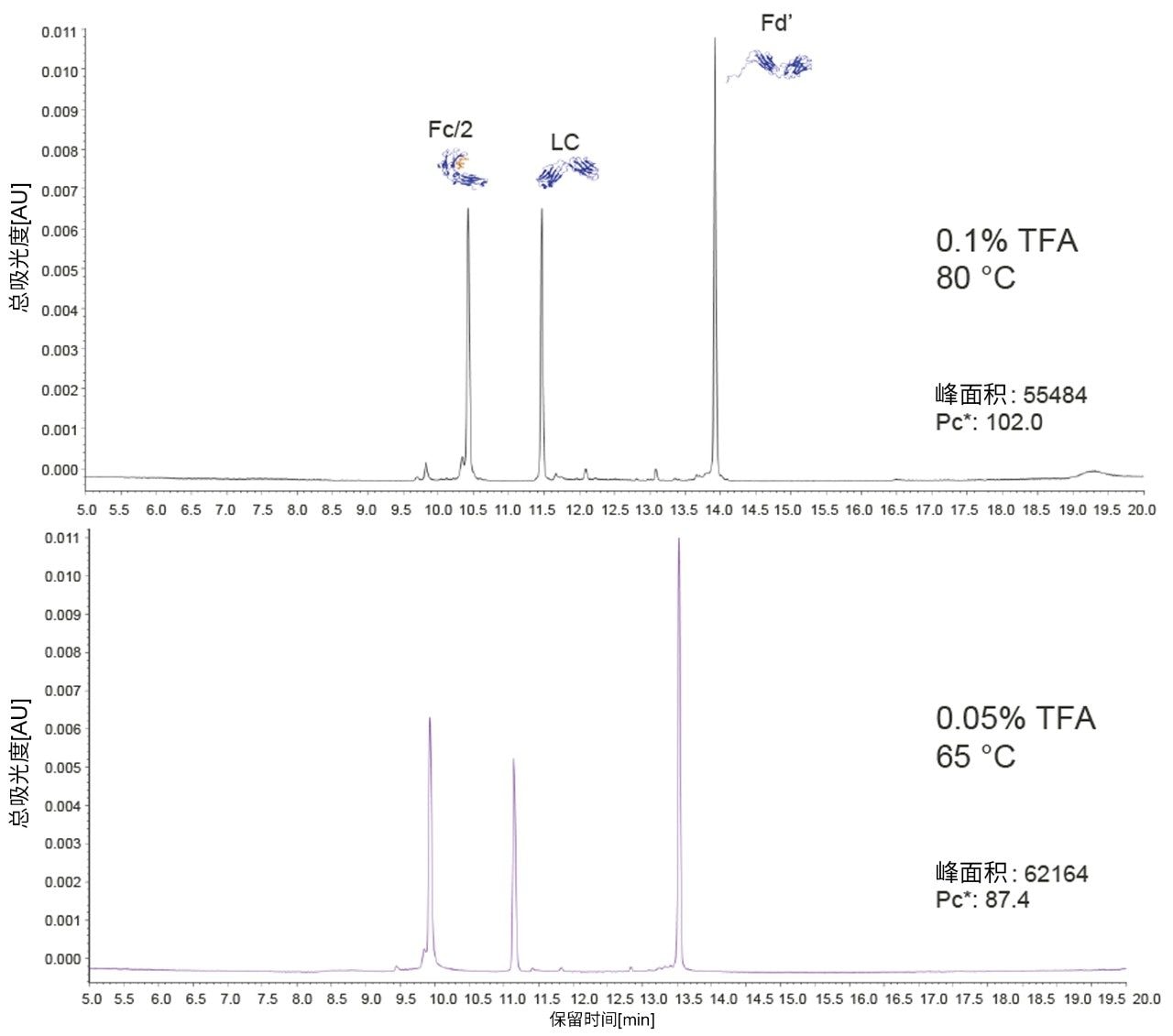
通过一个示例理解聚苯键合的独特性质,即使用低温和低浓度离子对添加剂进行的高分离度亚基分离方法开发。图9展示了使用2.1 × 150 mm色谱柱在两种不同条件下得到的mAb亚基标准品分离结果:(1)采用温度65 °C和添加0.05% TFA作为改性剂的流动相,以及(2)采用温度80 °C和添加0.1% TFA作为改性剂的流动相。在两种条件下,所有三个亚基峰(Fc/2、LC和Fd')均得到基线分离。通过仔细观察,还可以在两幅色谱图中看到来自低丰度物质的小峰。在65 °C/0.05% TFA的分离条件下,这些峰明显更小。在其他研究中已经观察到,低温和低浓度强酸将减小产生这些降解物的酸催化骨架裂解速率6,7。 具体而言,Fd'前峰可能对应于残基D88与P89之间的人为内部裂解6。降低TFA浓度和温度可显著减少这种降解。BioResolve RP色谱柱能够使用低温和低浓度离子对物质条件,有助于避免这些降解效应。
此外,使用低浓度TFA还有利于MS检测。总体而言,BioResolve RP色谱柱有利于在更适合MS和样品的条件下获得出色分离度,从而生成精密度更高的数据。相关示例可参见沃特世技术简报720006199ZH8。
沃特世专为BioResolve RP色谱柱开发了聚苯键合相,旨在提升mAb和mAb亚基RPLC分离的整体质量,从而挖掘更多有关蛋白治疗药物微异质性的信息。这种精心设计的键合相具有高覆盖率苯基填料的出众优势,因此蛋白质分离能力令人瞩目。BioResolve RP色谱柱不仅选择性优于其他固定相,而且在使用多种离子对试剂的条件下均可提高峰容量。此外,得益于键合覆盖率高的固有特性,聚苯填料的酸稳定性很出色,这有助于减少残留,从而能在温度更低和离子对试剂更弱的条件下完成分离。综上,BioResolve RP色谱柱的新型键合相可协助色谱工作者改善分离度,以及探索温度更低、MS兼容性更好的色谱条件。
720006169ZH,2018年3月