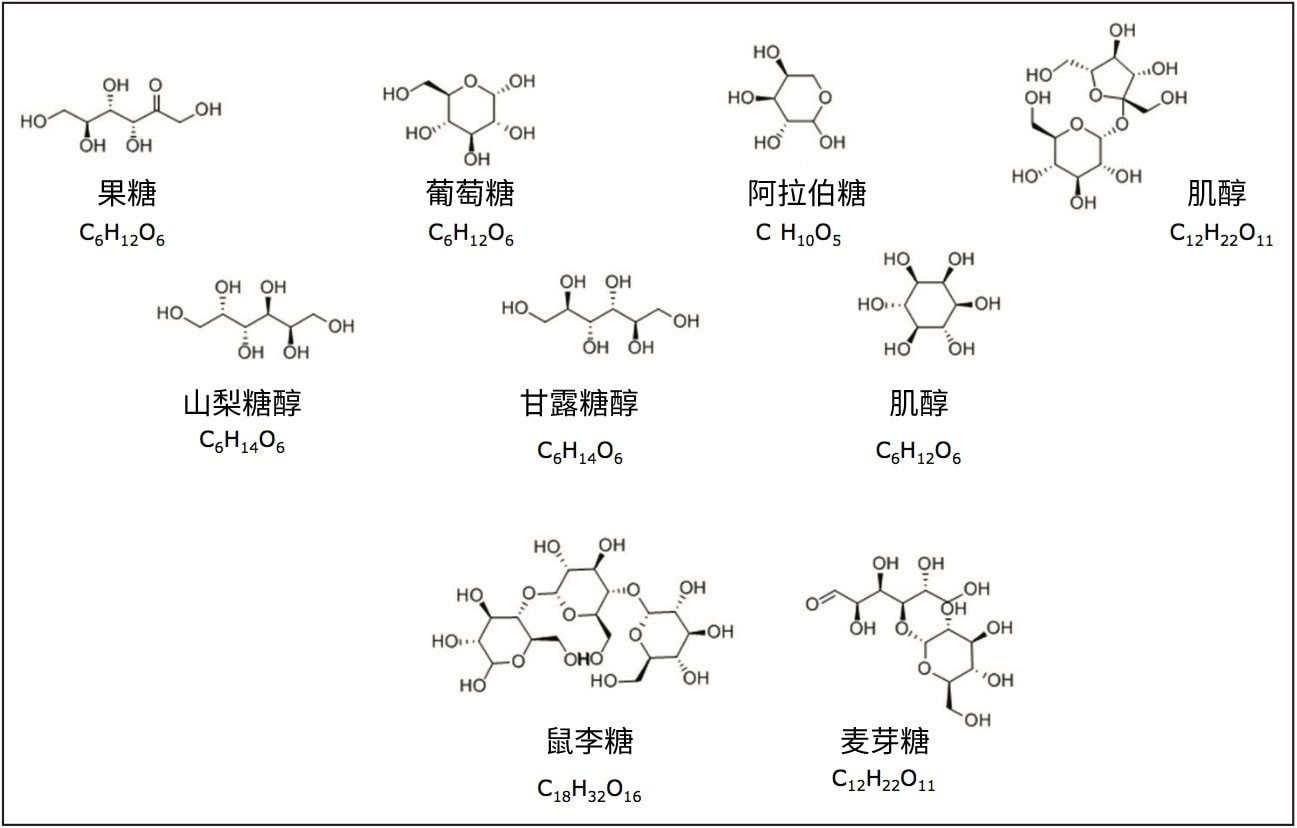
由于缺乏发色团且分子之间非常相似,糖类和糖醇类的分析一直以来都是一项具有挑战性的应用。许多糖类化合物彼此互为异构体。
HPLC凭借其分离能力、准确度和分析速度方面的优势,成为了糖类分析的理想方法。示差折光(RI)或蒸发光散射(ELS)检测的替代方法是电喷雾离子(ESI)质谱检测,质谱检测是对传统LC检测器的补充。在本研究中,我们有机会在降低检测限的同时获得样品中各成分的质谱信息。色谱保留时间与质量信息的结合能够提升糖类和糖醇分析的选择性。
本应用纪要展示了将ACQUITY QDa质谱检测器与ACQUITY Arc系统联用,对果汁、葡萄酒、啤酒和威士忌样品中的糖类进行分析和定量的应用。
糖类和糖醇类物质都属于碳水化合物,对于人类而言是非常重要的营养物质,也是食物中的天然成分。随着发达国家的肥胖症和糖尿病患病率日益上升,近年来人们对于监控糖类摄入量的关注也急剧增加。因此,要满足日益严格的法规要求,食品标签提供的信息必须准确无误。分析产品中糖类的含量也是辨别产品真伪和识别掺假行为的有用工具。
由于缺乏发色团且分子之间非常相似,糖类和糖醇类的分析一直以来都是一项具有挑战性的应用。许多糖类化合物彼此互为异构体,图1展示了本研究所分析的化合物的分子式和结构。HPLC凭借其分离能力、准确度和分析速度方面的优势,成为了糖类分析的理想方法。RI和ELS检测的替代方法是电喷雾离子(ESI)质谱检测。质谱检测是对传统LC检测器的补充。
|
液相色谱系统: |
ACQUITY Arc |
|
数据系统: |
Empower 3 |
|
运行时间: |
40.0 min |
|
色谱柱: |
XBridge XP BEH Amide 2.5 µm, 3.0 x 150 mm |
|
柱温: |
85 °C |
|
流动相A: |
90%乙腈:5%异丙醇:5%水* |
|
流动相B: |
80%乙腈:20%水* |
|
流速: |
0.8 mL/min |
|
进样体积: |
1 µL |
*均含有500 ppb盐酸胍和0.05%二乙胺。
|
时间(min) |
流速(mL/min) |
%A |
%B |
|---|---|---|---|
|
初始 |
0.8 |
100.0 |
0.0 |
|
4.5 |
0.8 |
100.0 |
0.0 |
|
18.0 |
0.8 |
0.0 |
100.0 |
|
25.0 |
0.8 |
0.0 |
100.0 |
|
25.1 |
0.8 |
100.0 |
0.0 |
|
40.0 |
0.8 |
100.0 |
0.0 |
|
质谱系统: |
ACQUITY QDa(Performance版本) |
|
电离模式: |
ESI- |
|
毛细管电压: |
0.8 V |
|
锥孔电压: |
5.0 V |
|
探头温度: |
600 °C |
|
采集速率: |
2 Hz |
|
全扫描: |
50~800 Hz |
|
曲线拟合: |
二次曲线,1/x加权 |
|
平滑: |
均值过滤器,7级 |
使用乙腈-水(1:1)制备含上述9种糖类的储备溶液,浓度为100 mg/L。将该储备溶液进一步稀释为9个不同的浓度(1、2、4、5、10、20、40、50和100 mg/L)。
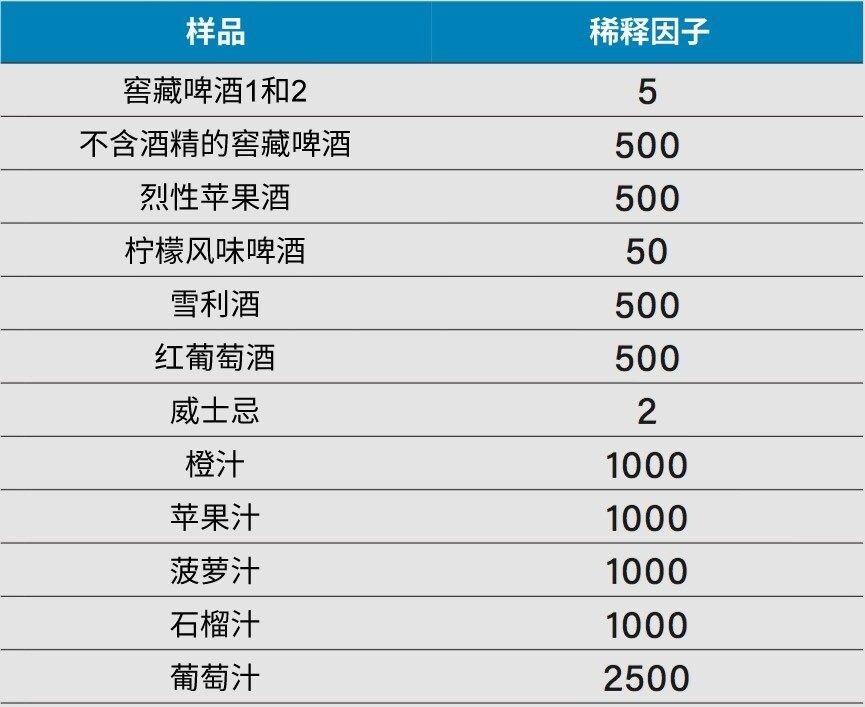
所有样品均购自当地。所分析的果汁样品包括橙汁、苹果汁、菠萝汁、石榴汁和葡萄汁。所分析的酒精性饮料包括5种啤酒、3种窖藏啤酒(其中1种不含酒精)、1种柠檬风味啤酒、1种烈性苹果酒、1种雪利酒、1种红葡萄酒和4种威士忌。啤酒样品经超声处理去碳酸化。所有样品均采用0.22 µm PVDF注射式过滤器过滤,并使用乙腈-水(1:1)稀释。稀释因子列于表1中。
| SIR通道: | ||
| 分析物 | 化学式 | SIR (m/z)([M+Cl]-离子) |
| 阿拉伯糖 | C5H10O5 | 185 |
| 果糖 | C6H12O6 | 215 |
| 葡萄糖 | C6H12O6 | 215 |
| 肌醇 | C6H12O6 | 215 |
| 山梨糖醇 | C6H14O6 | 217 |
| 甘露糖醇 | C6H14O6 | 217 |
| 蔗糖 | C12H22O11 | 377 |
| 麦芽糖 | C12H22O11 | 377 |
| 鼠李糖 | C18H32O16 | 539 |
在本研究中,我们有机会在降低检测限的同时获得样品中各成分的质谱信息。色谱保留时间与质量信息的结合能够提升糖类和糖醇分析的选择性。在这里,我们展示了将Waters ACQUITY QDa质谱检测器与ACQUITY Arc系统联用,对果汁、葡萄酒、啤酒和威士忌样品中的糖类进行分析和定量的应用。
图2展示了配备有ACQUITY QDa质谱检测器和PDA检测器的ACQUITY Arc系统。图中展示的PDA仅供参考,本应用并未使用。图3为100 mg/L混合标准品的SIR色谱图,图中分别标出了上述9种分析物。所有标准品的分离结果都很出色。首先使用等度条件分离质量较小的糖类,其中包括难分离异构体对山梨糖醇和甘露糖醇。4.5分钟后启用梯度,及时分离混合物中分子量较大的糖类。

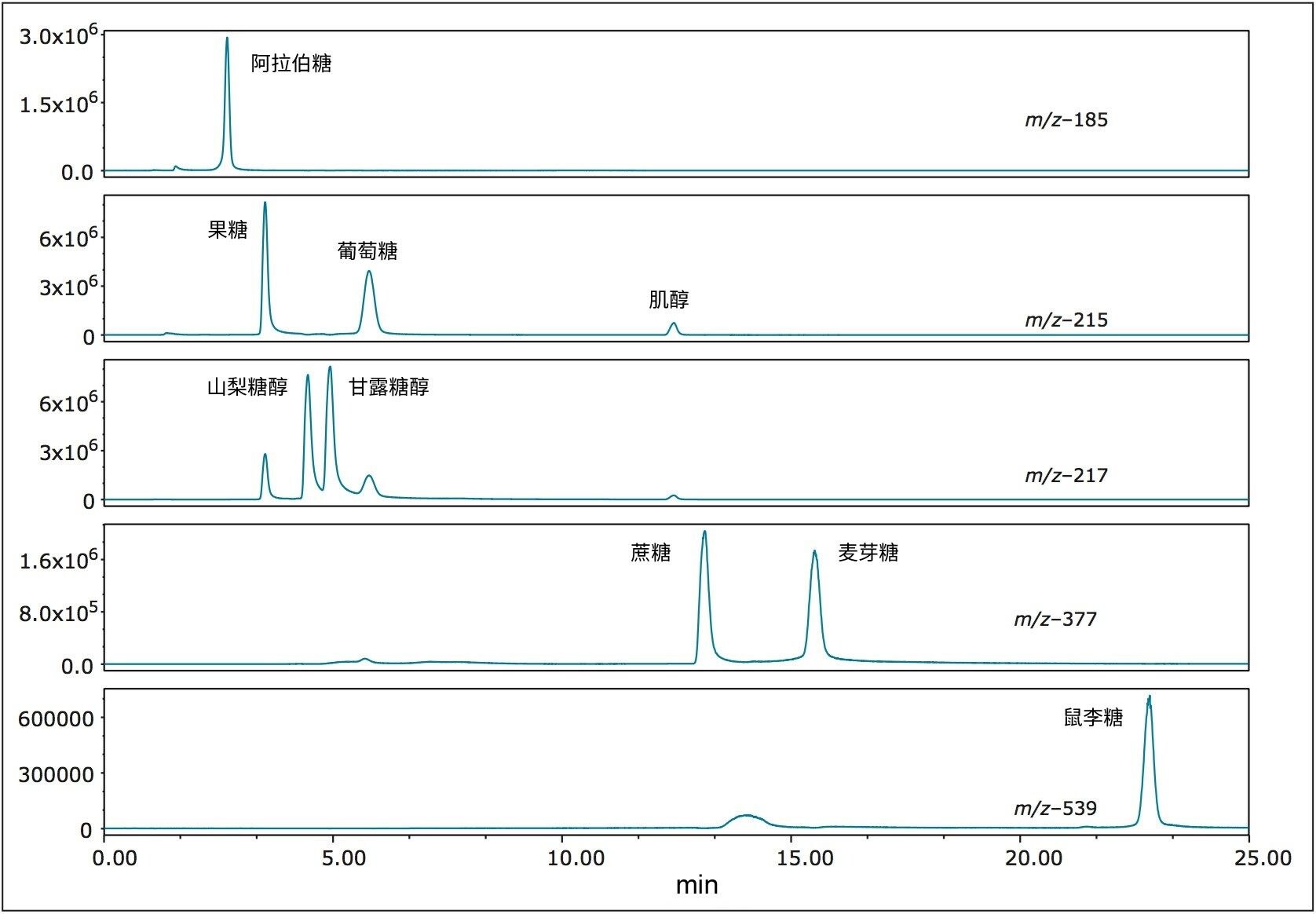
图4展示了从各标准品的SIR中提取的质谱图。流动相中添加了盐酸胍,可确保化合物形成氯加合物([M+Cl]-离子)。图中还显示了较弱的37Cl加合物响应。图5展示了所研究化合物的校准曲线。所有分析物的R2值均大于0.995。
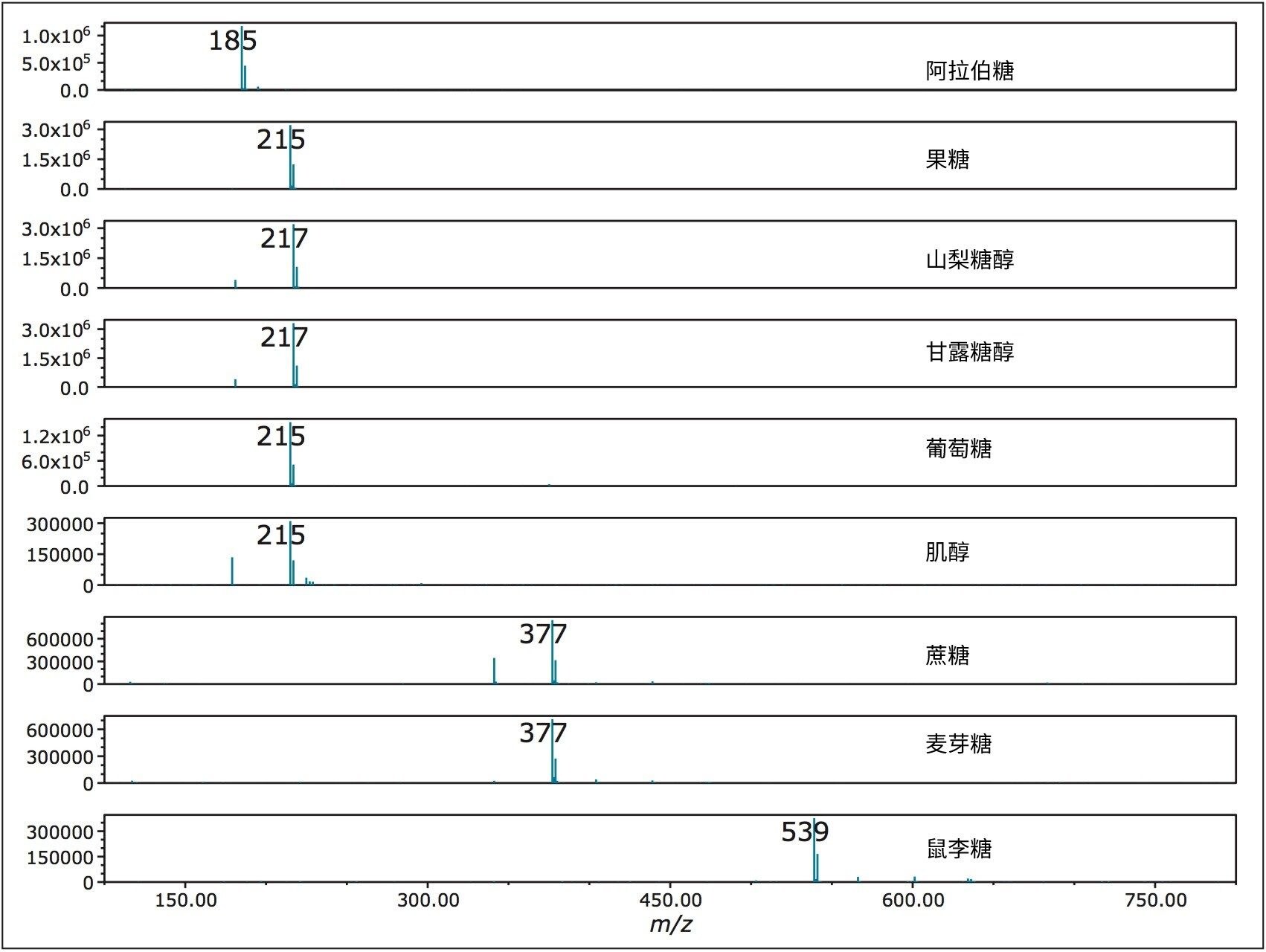
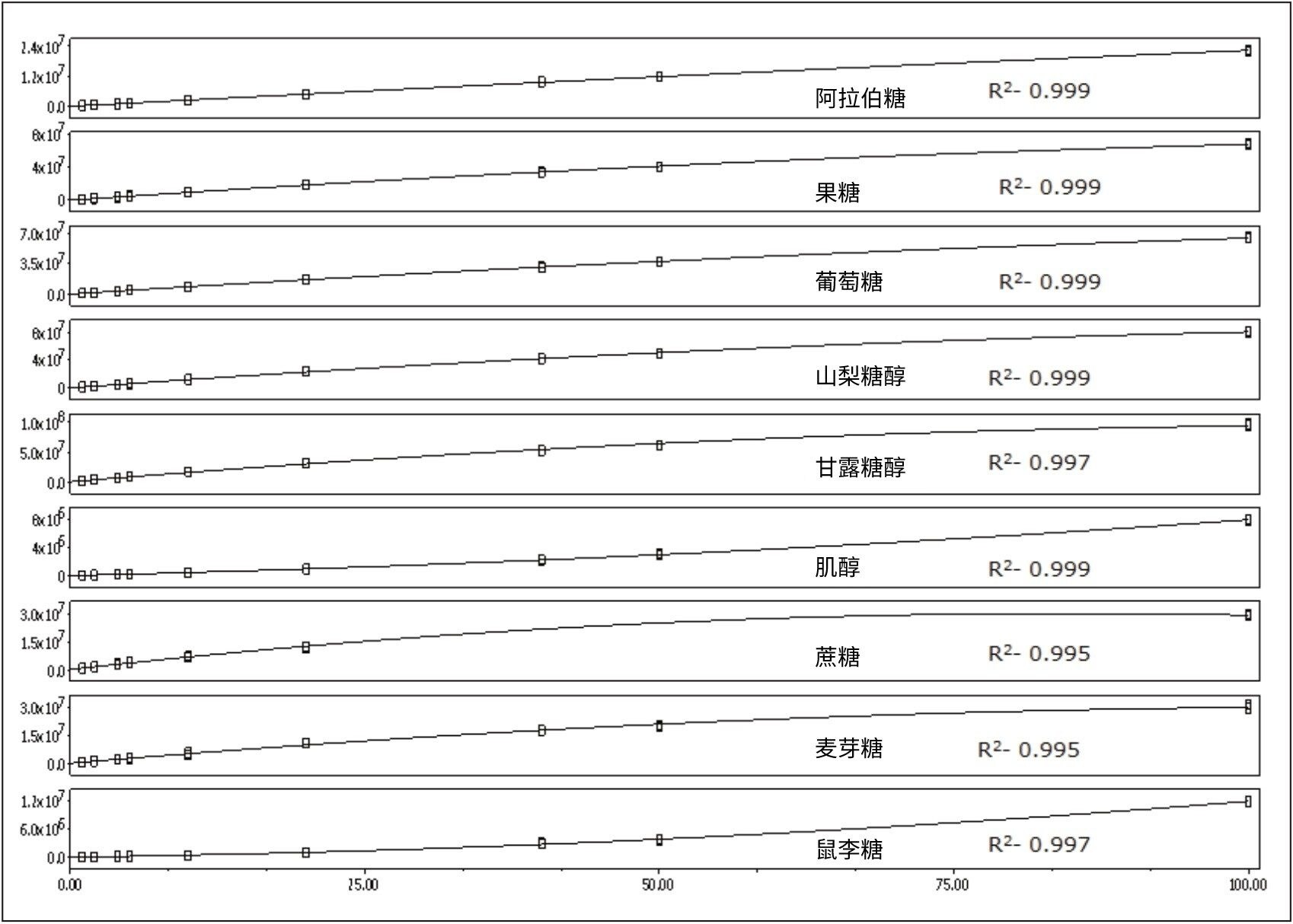
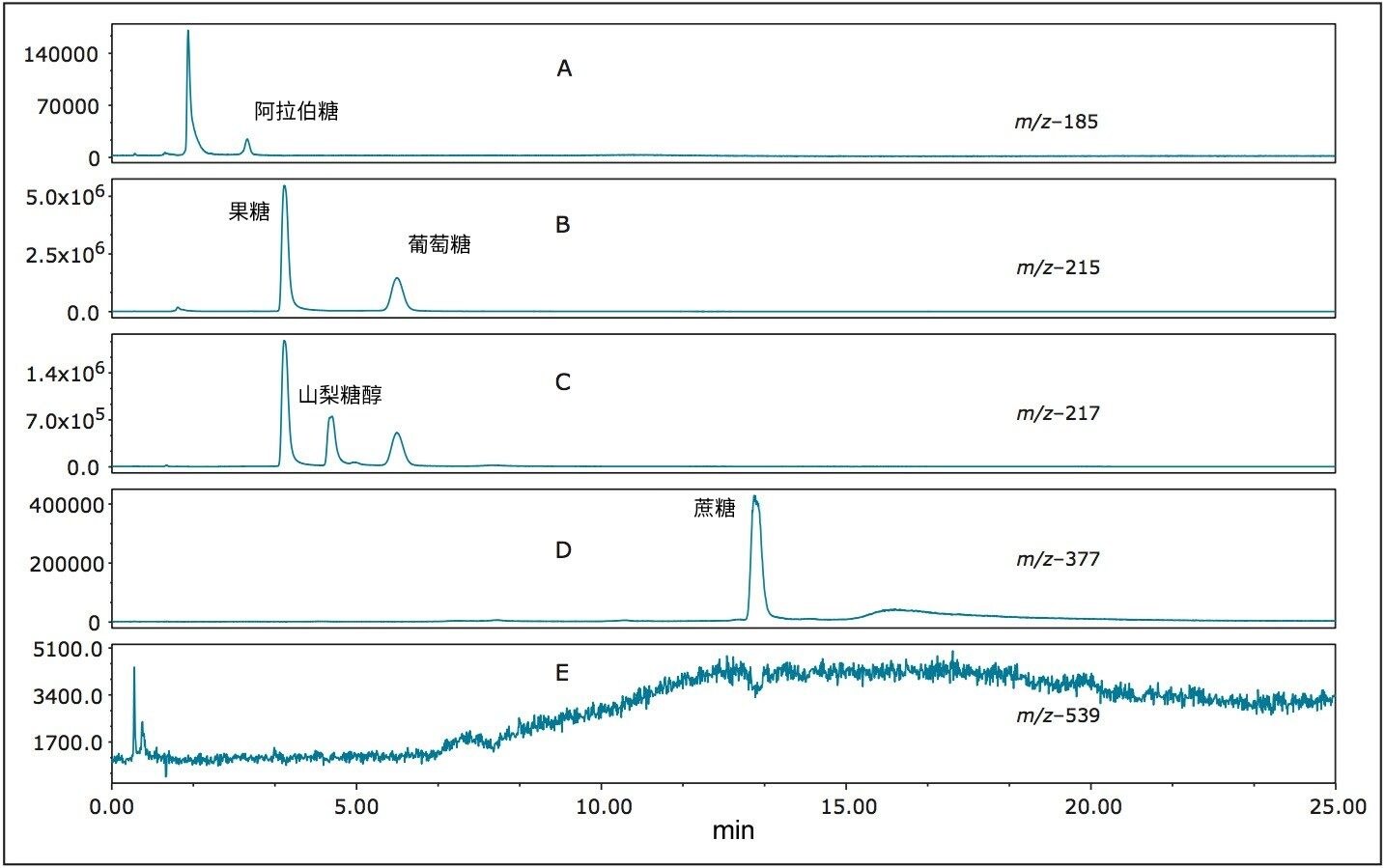
图6 (A–E)展示了窖藏啤酒的SIR分析结果。图6A (m/z 185)中出现了阿拉伯糖,但还存在其他峰,这表明样品中含有其他戊糖。在图6B (m/z 215)中可以看到果糖和葡萄糖。与灵敏度较低的方法(如示差折光法)相比,ACQUITY QDa的高灵敏度改善了这些化合物的检测结果1。 在图6C (m/z 217)中可以看到山梨糖醇和甘露糖醇。我们还可以看到代表提取到的果糖和葡萄糖Cl37加合物的小峰,它们与山梨糖醇和甘露糖醇具有相同的分子量。在图5D和5E(m/z分别为377和539)中,我们可以观察到麦芽糖和鼠李糖的DP2和DP3化合物,以及相同质量的异构体(可能出现在由谷物制成的饮料中)。
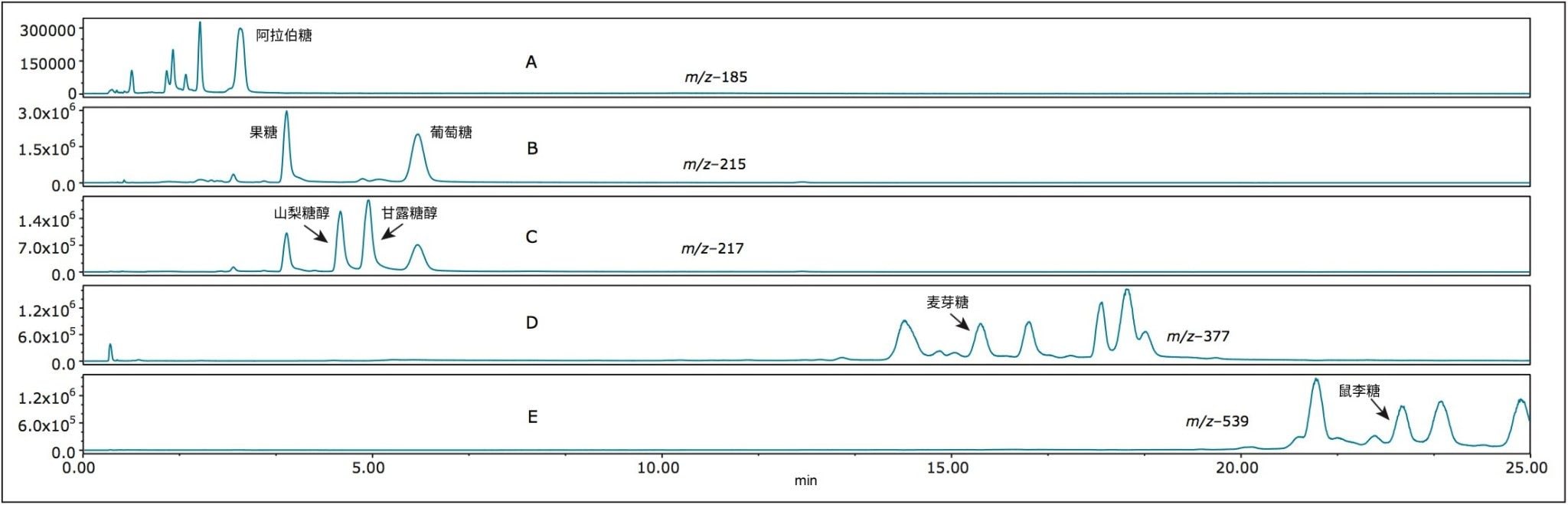
图7 (A–E)展示了雪利酒的分析结果。在雪利酒中检测到的主要分析物为果糖和葡萄糖(图7B)。此外还有少量的阿拉伯糖(图7A)以及痕量的山梨糖醇和甘露糖醇(图7C),还可以明确检测到麦芽糖(图7D)。如我们所预期,样品中不存在DP3化合物(图7E),因为雪利酒的主要原料是葡萄而非谷类。
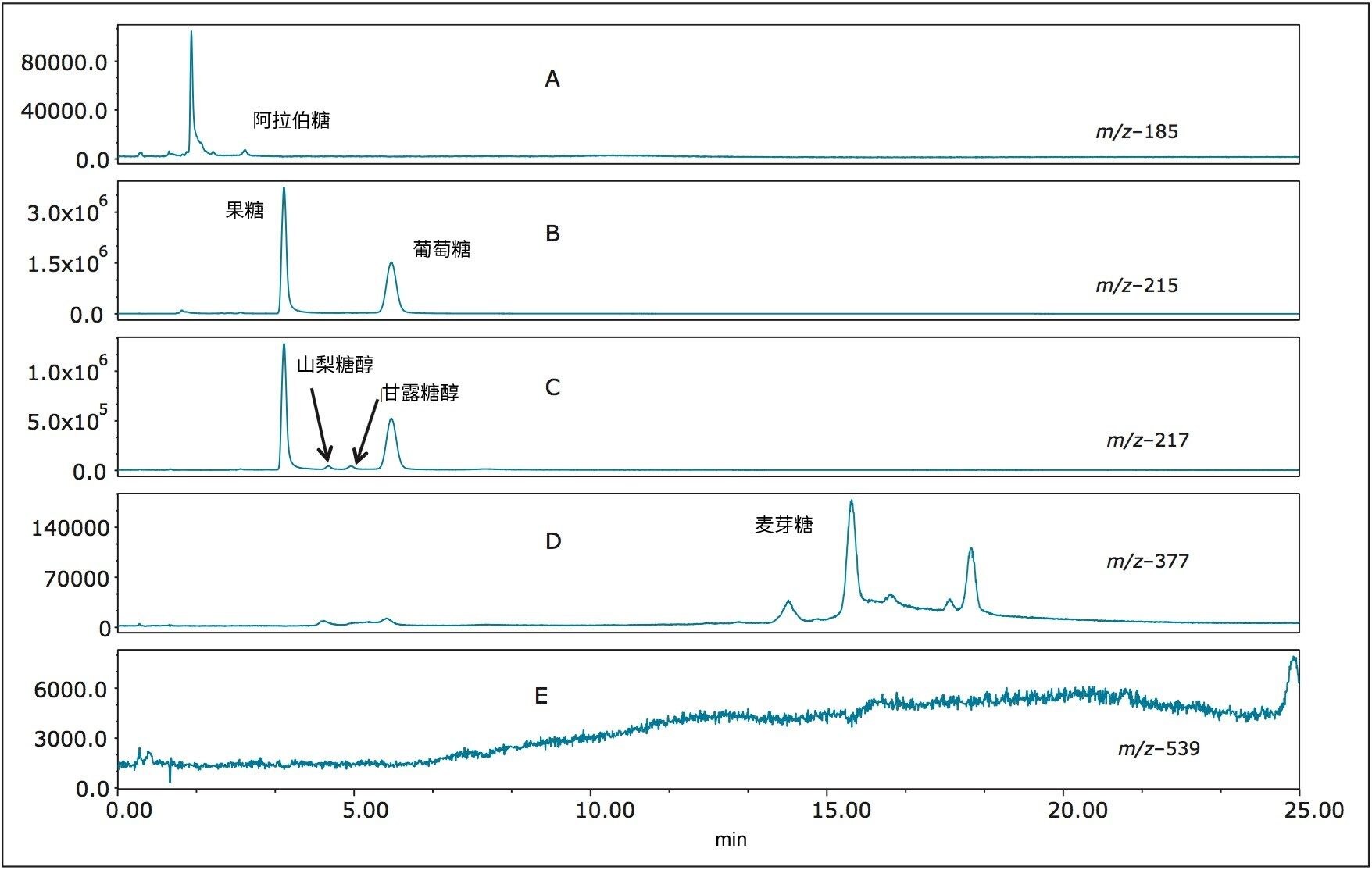
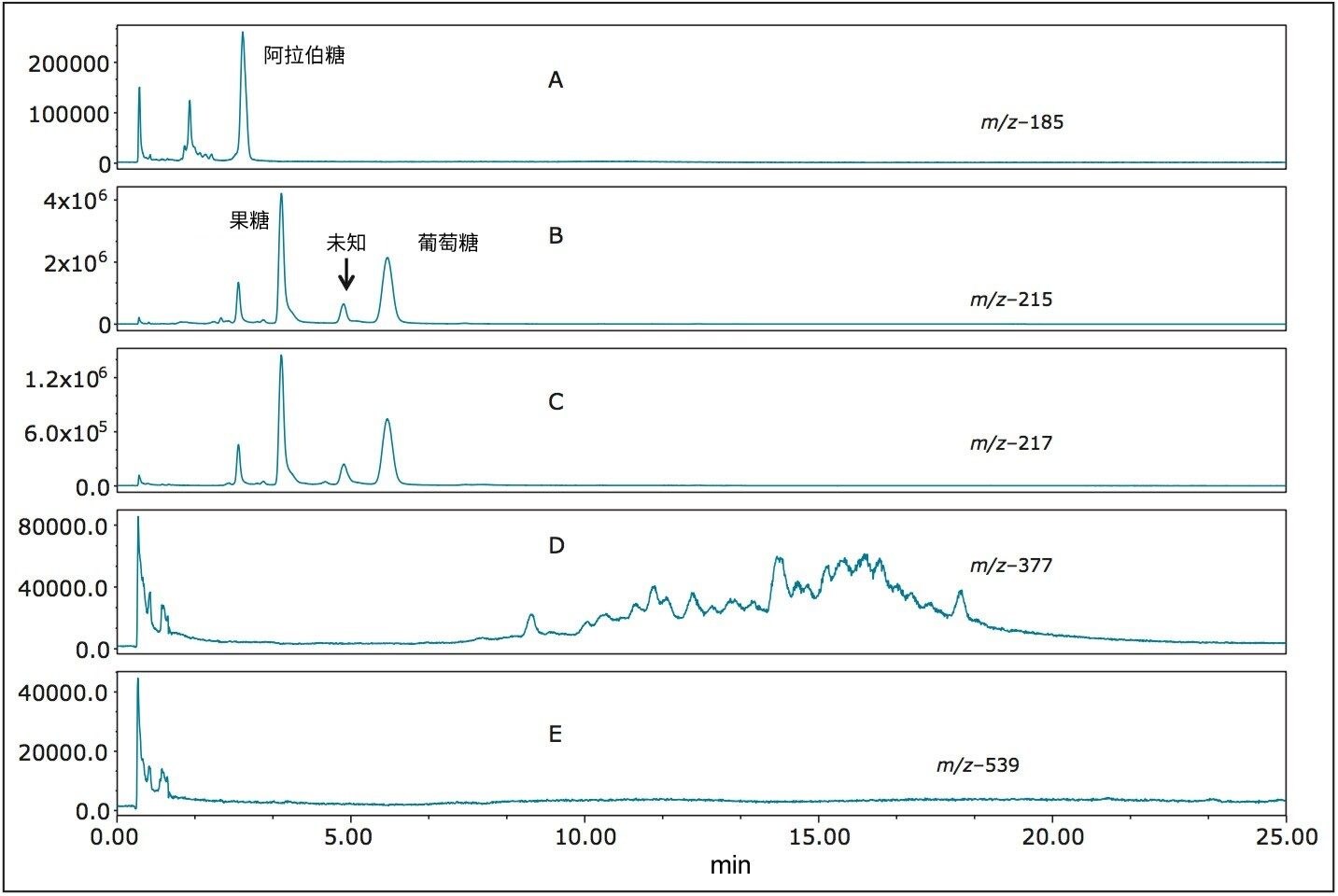
图8 (A–E)展示了威士忌样品的SIR分析结果。样品中存在阿拉伯糖(图8A),还可以明确检测到果糖和葡萄糖(图8B)。特别值得注意的是,在图8B (m/z 215)和8C (m/z 217)中,保留时间4.85分钟处均出现了一种未知的糖类。如果仅参考RI和ELS检测器得到的保留时间,该峰很可能被误鉴定为甘露糖醇。m/z 215和m/z 217处均出现了该峰,表明该化合物具有与单糖(而非糖醇)相同的质量,而且甘露糖醇不产生m/z 215的离子(如图2和3所示)。
最后,图9 (A–E)展示了苹果汁样品的SIR色谱图。图中突显了样品中存在的阿拉伯糖、果糖、葡萄糖、山梨糖醇和蔗糖。
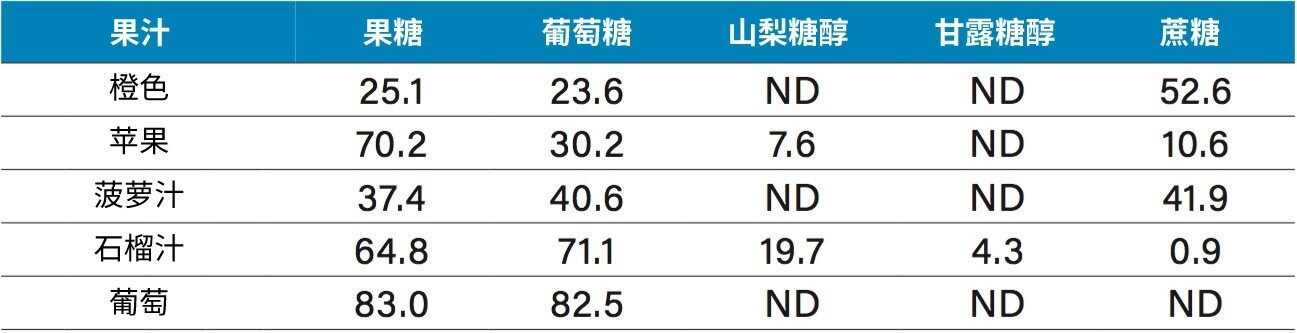
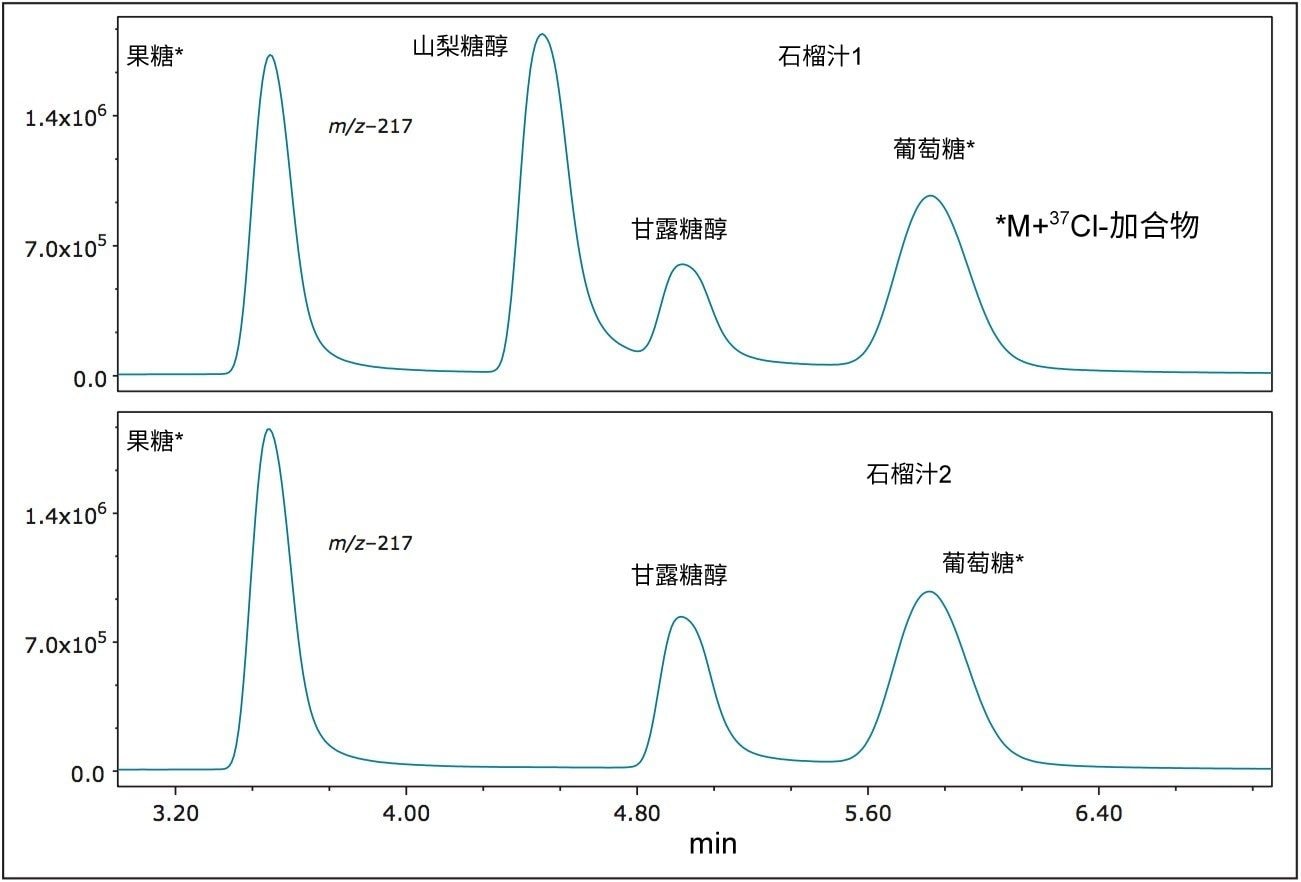
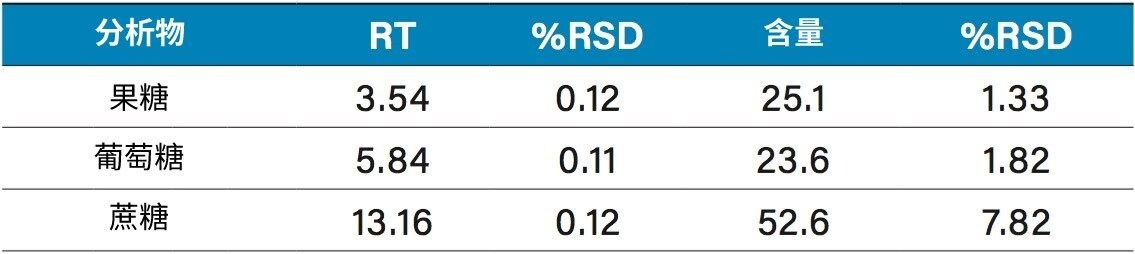
各种果汁的定量结果如表2所示。橙汁、苹果汁和菠萝汁中含有果糖、葡萄糖和蔗糖。这些果汁中糖类的含量和比例与其他报道的数据类似2,3。 值得注意的是,我们在石榴汁中检测到了山梨糖醇。山梨糖醇一般不会出现在石榴汁4中,因此该检测结果表明样品可能掺假。测试第二个样品时未检测到山梨糖醇(图10)。在葡萄汁样品中检测到了果糖和葡萄糖,但没有检测到预期应该存在的蔗糖2,3。
720005609ZH,2017年3月