
本应用纪要介绍了一种定量分析三聚氰胺、三聚氰酸和双氰胺的方法,该方法将Waters ACQUITY QDa质谱检测器与ACQUITY UPLC H-Class系统联用,操作简单、结果一致性高。在本实验所研究的5种加标基质中,3种目标分析物的回收率均在75% ~ 123%范围内。
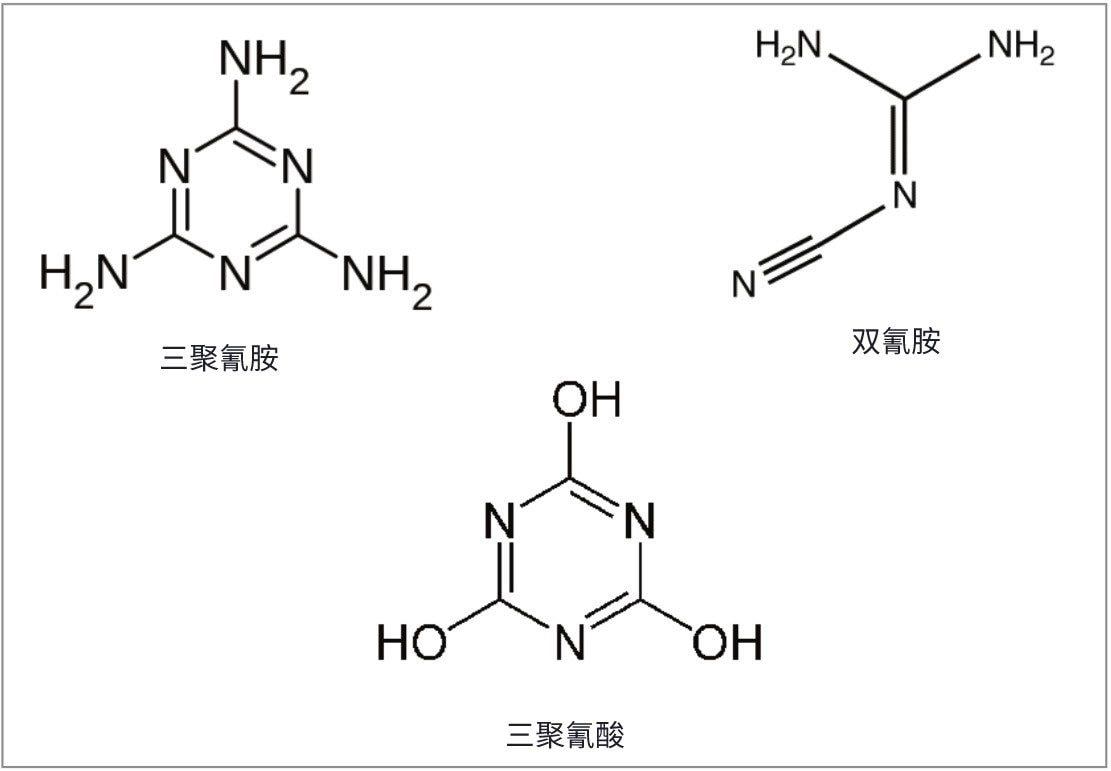
三聚氰胺和三聚氰酸(图1)是富含氮元素的低质量数化合物,人们早就意识到,多种食品中的蛋白质掺假都与这两种物质有关1。 虽然三聚氰胺和三聚氰酸各自本身并不具有毒性,但是二者有时会通过氢键相结合,形成名为氰尿酸三聚氰胺的加合物,这种物质能够产生尖锐的晶体,可造成内脏器官功能衰竭,甚至导致死亡2。 还有一种类似的化合物,双氰胺(DCD),它本来是用于最大程度减小放牧牲畜对环境的破坏,但目前已在新西兰的乳制品中发现了低含量的该化合物3。 三聚氰胺在婴儿配方奶粉中的已公布限量为1 mg/kg,在其他食品和动物饲料中为2.5 mg/kg。这些值是根据三聚氰胺及其类似物0.64 mg/kg体重(bw)的TDI(每日可耐受摄入量)而规定的4。 最近,监管机构又公布了更为严格的三聚氰胺及其类似物的TDI — 0.2 mg/kg体重5。 欧洲食品安全局针对DCD发布的TDI为1 mg/kg体重6。 由于这些化合物的极性较强,因此反相分析方法的效果通常不好。目前的方法采用HILIC色谱柱或离子对机制7,通常配合MS/MS检测。
本应用纪要介绍了一种定量分析三聚氰胺、三聚氰酸和双氰胺的方法,该方法将Waters ACQUITY QDa质谱检测器与ACQUITY UPLC H-Class系统联用,操作简单、结果一致性高。
|
液相色谱系统: |
ACQUITY UPLC H-Class |
|
CDS数据系统: |
Empower 3 |
|
运行时间: |
14.0 min |
|
色谱柱: |
ACQUITY UPLC BEH Amide 1.7 μm, 2.1 x 150 mm |
|
柱温: |
35 °C |
|
流动相A: |
50:50水:乙腈,10 mM甲酸铵,0.125%甲酸 |
|
流动相B: |
10:90水:乙腈,10 mM甲酸铵,0.125%甲酸 |
|
流速: |
0.6 mL/min |
|
进样体积: |
5 μL |
|
序号 |
时间(min) |
流速(mL/min) |
%A |
%B |
|---|---|---|---|---|
|
1 |
初始 |
0.6 |
2 |
98 |
|
2 |
3.0 |
0.6 |
2 |
98 |
|
3 |
3.5 |
0.6 |
98 |
2 |
|
4 |
4.0 |
0.6 |
98 |
2 |
|
5 |
4.1 |
0.6 |
2 |
98 |
|
6 |
14.0 |
0.6 |
2 |
98 |
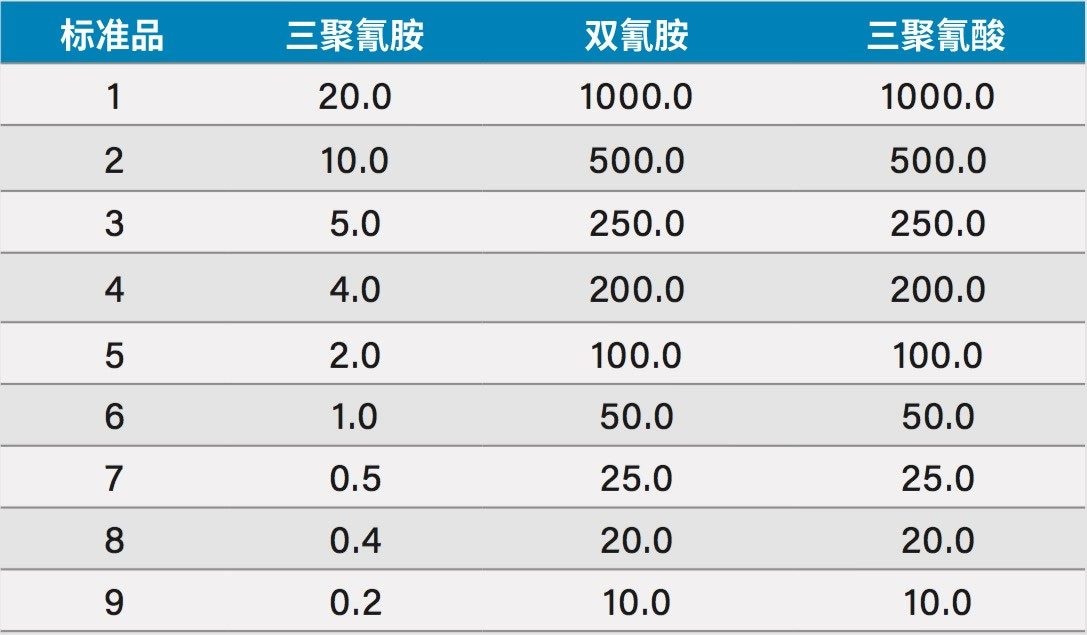
用水分别制备浓度为1000 mg/L的三聚氰胺、三聚氰酸和双氰胺标准品。使用上述标准品和水制备三聚氰胺、三聚氰酸和DCD浓度分别为2 mg/L、100 mg/L和100 mg/L的标准品中间混合物。使用10:90水:乙腈按1:100的比例稀释该标准品,得到三聚氰胺、三聚氰酸和DCD的浓度分别为20 µg/L、1000 µg/L和1000 µg/L的标准品。使用10:90水:乙腈得到该标准品的9个稀释梯度,用于制作分析物的校准曲线,具体值如表1所示。
|
质谱系统: |
ACQUITY QDa (Performance) |
|
电离模式: |
ESI+/- |
|
毛细管电压: |
0.8 kV正离子,0.6 kV负离子 |
|
探头温度: |
缺省(600 ℃) |
|
离子源温度: |
缺省(120 ℃) |
|
SIR: |
m/z 127.1,正离子 |
|
锥孔电压: |
15 V |
|
SIR: |
m/z 128.0,负离子 |
|
锥孔电压: |
10 V |
|
IR: |
m/z 85.1,正离子 |
|
锥孔电压: |
10 V |
|
采集速率: |
5 Hz |
|
全扫描采集: |
m/z 50~300 |
|
锥孔电压: |
15 V |
|
正离子和负离子,棒状图 |
将1 g奶粉或婴儿配方奶粉溶于10 mL 2%甲酸水溶液中。取1 mL液态婴儿配方奶添加到9 mL 2%甲酸水溶液中。然后取1 mL该溶液添加到9 mL乙腈中并充分混合。将样品放置20分钟,待蛋白质沉淀之后在2233 g rcf下离心20分钟。然后取1 mL所得的上清液上样至之前已使用6 mL 10:90水:乙腈平衡过的认证Sep-Pak 6-cc硅胶小柱(部件号186004616)。用4 mL 10:90水:乙腈对小柱进行洗脱,然后进样分析获得的洗脱液。本实验共研究了5个奶粉和婴儿配方奶粉样品(包括粉状和液态样品、乳制奶粉和大豆蛋白奶粉样品)。
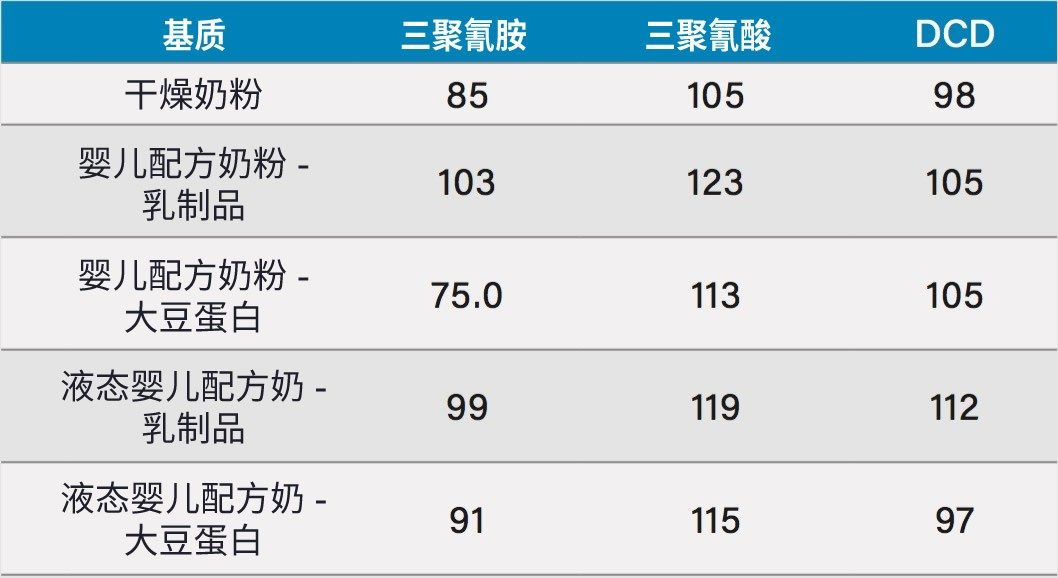
研究中执行了加标实验以确定回收率。将1 mg/L三聚氰胺和20 mg/L三聚氰酸、双氰胺加标到1 g(1 mL液态婴儿配方奶)样品中。对上述五个样品执行相同的操作。每个样品均按照上述样品前处理方案进行制备。回收率值如表2所示。
HILIC是分离本应用中三种分析物的理想技术。本应用研究了两种不同的HILIC色谱柱:BEH HILIC色谱柱和BEH Amide色谱柱。图2比较了分析物在两种色谱柱上的保留性,其中二氢苊被用作指示两种填料对分析物无保留的标记。如图2A所示,三聚氰酸和双氰胺在HILIC色谱柱的未键合BEH颗粒上的保留性很低。ACQUITY UPLC BEH Amide色谱柱的三官能团氨基甲酰键合相对目标分析物的保留性明显更强(图2B),因此是更优的色谱柱选择。如图2B所示,三种分析物之间实现了出色的分离效果。三聚氰胺是三种分析物中保留性最强的,并且在三分钟之内即可洗脱。
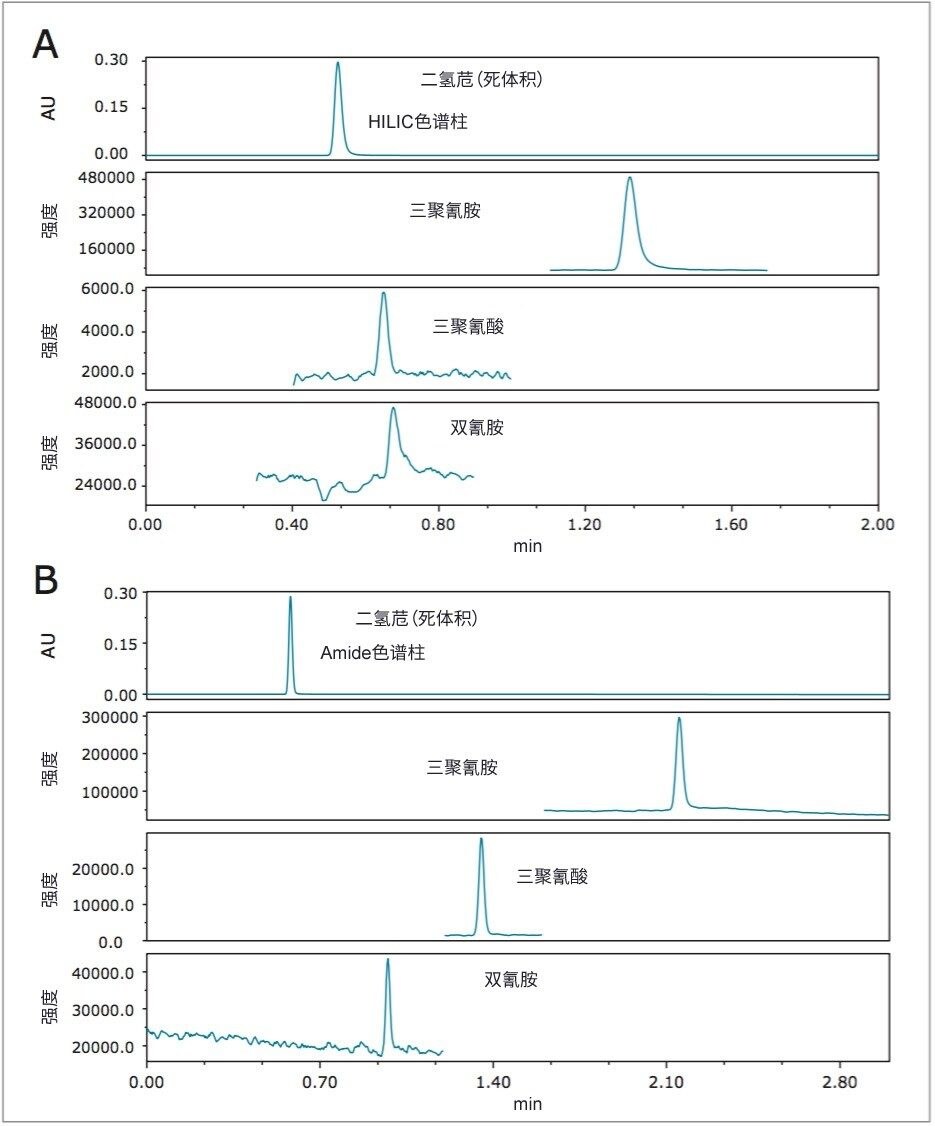
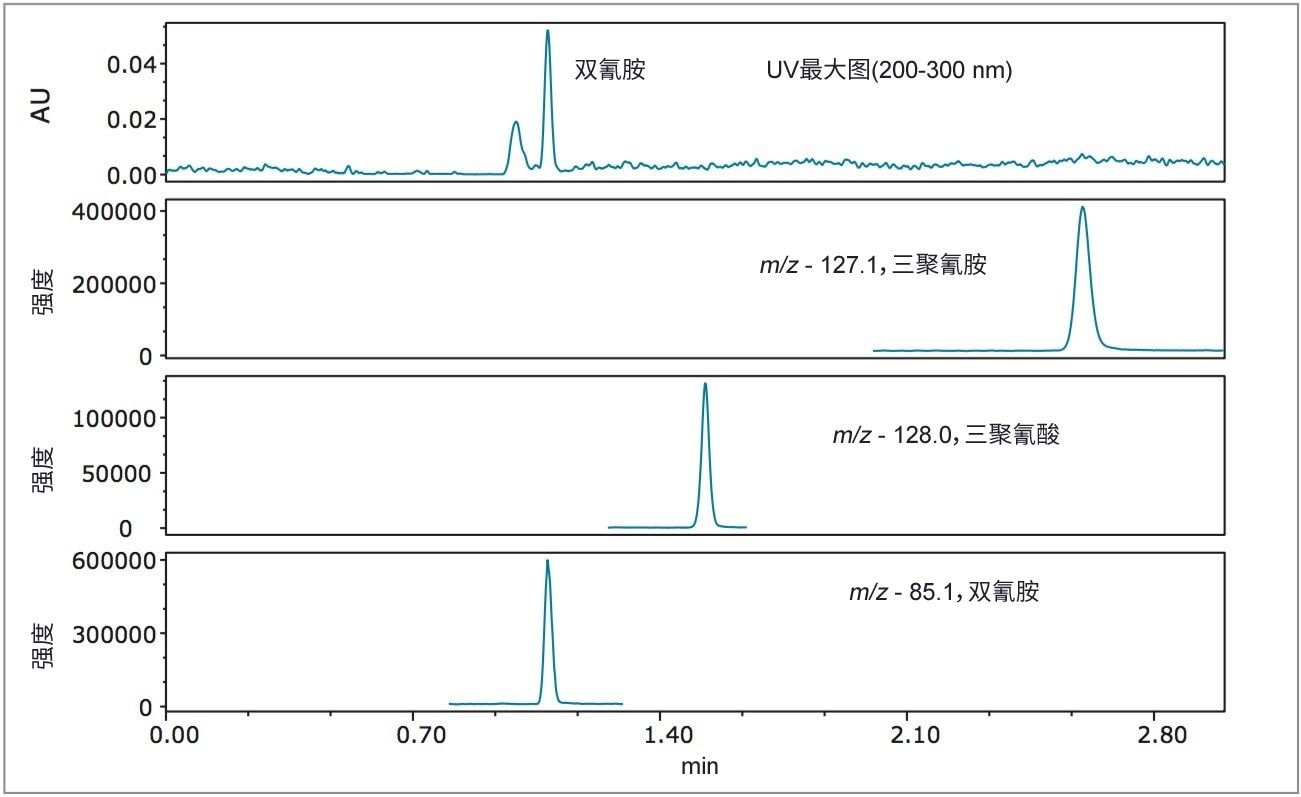
图3是标准品1的UV最大图*与每种分析物(20 µg/L三聚氰胺、1000 µg/L三聚氰酸和双氰胺)的SIR通道图谱的叠加图。如图3所示,在UV迹线中只有双氰胺不明显,但是所有三种分析物在其各自的SIR通道中均显示出较强的信号,证明使用质谱检测可提高这些分析物的分析灵敏度。
为了采用示例性样品评估该色谱方法,我们在本地商店购买了五种不同的样品(脱脂奶粉、乳制婴儿配方奶粉、大豆蛋白婴儿配方奶粉、乳制液态婴儿配方奶和大豆蛋白液态婴儿配方奶)。分析这些样品之后,我们明显地发现样品中有一种未知化合物会在与三聚氰胺相似的保留时间处洗脱。该化合物会在三聚氰胺洗脱之后不久对SIR色谱图产生抑制。与SIR色谱图同时采集的全扫描MS数据有助于我们进一步研究产生该现象的原因。结果显示该化合物的m/z为104.1(数据未展示),而且所检测的所有基质中均含有该物质。为了去除对三聚氰胺响应的抑制效应,我们使用认证Sep-Pak硅胶小柱进行了直通式净化。该方法的效果如图4所示,该图比较了使用和不使用Sep-Pak小柱净化的加标婴儿配方奶粉样品分析结果。
图4A展示了未经净化的加标婴儿配方奶粉样品中三聚氰胺的SIR曲线。三聚氰胺洗脱之后基线的下降表明信号受到了显著的抑制,如前文所述。图4B中的m/z 104.1处的提取离子色谱图展示了造成这种抑制的相应色谱峰。图4B中色谱的强度还表明该化合物的浓度比目标分析物高很多。
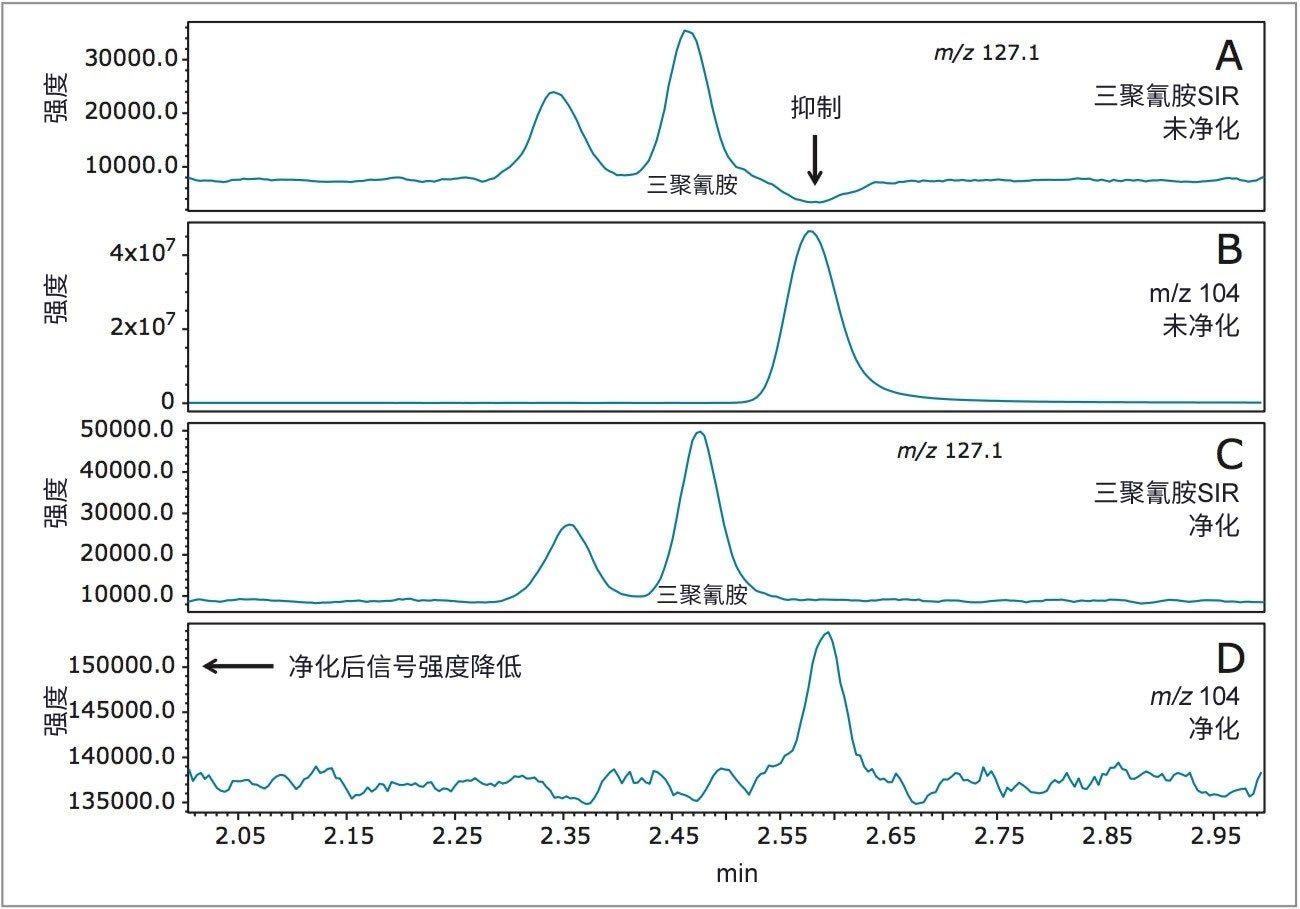
如图4C所示,净化之后,三聚氰胺SIR色谱图的基线不再受影响。图4D为净化之后m/z 104.1处的提取离子色谱图。
m/z 104.1的响应比未经净化的样品约低250。该方法开发研究和方法改进是通过在分析时对选定的目标分析物SIR迹线同时进行全扫描采集而实现的。
SIR分析能够在筛查目标分析物所需的最低浓度条件下实现高灵敏度的定量分析。全扫描MS数据能为方法开发和基质背景的改进提供有价值的信息。
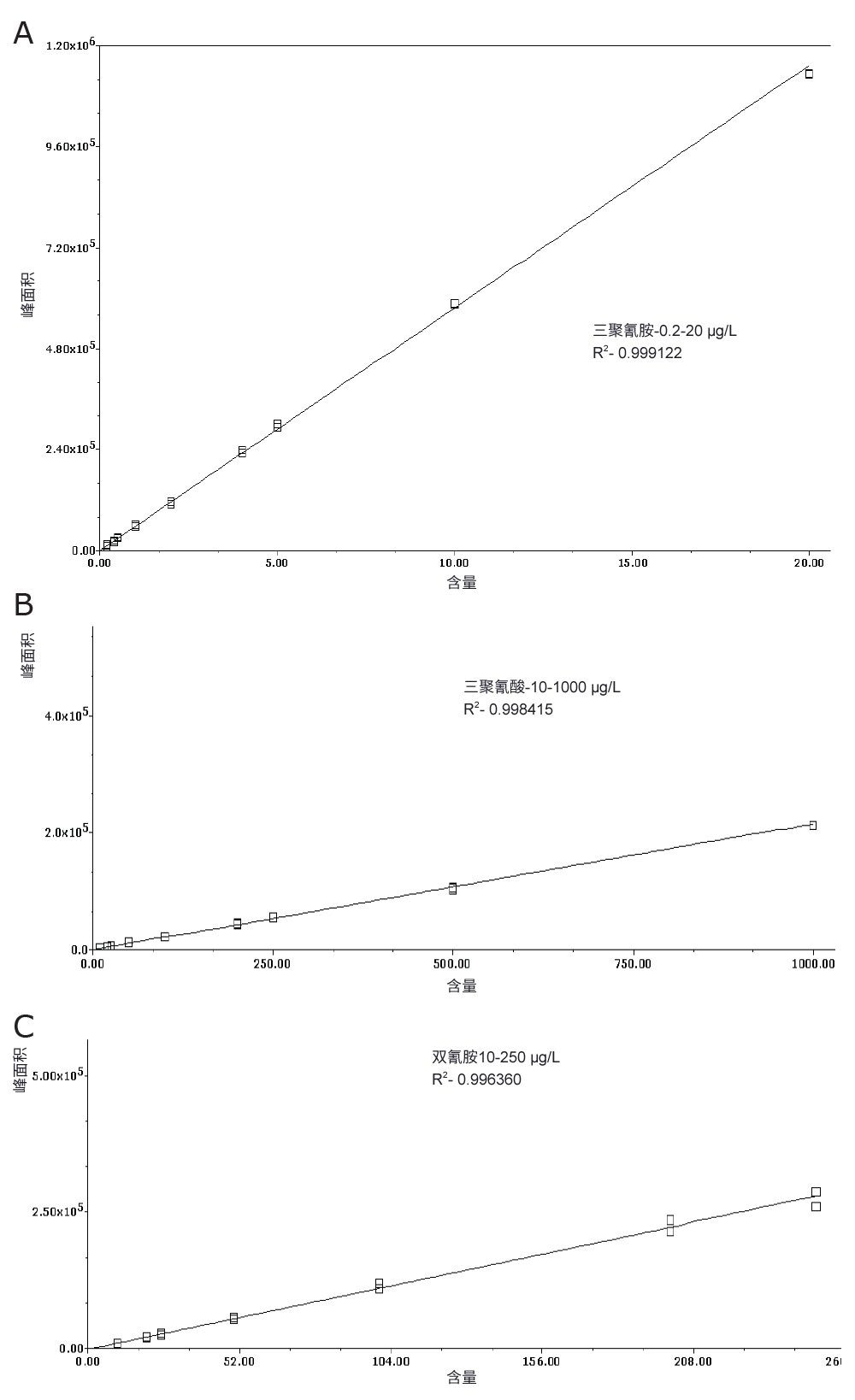
分析物的校准图如图5A–C所示。校准范围经过了筛选,以获得可用的线性校准曲线(三种化合物的线性范围各不相同,如图5所示)。所有分析物的回归系数均<0.996,且残差<20%。
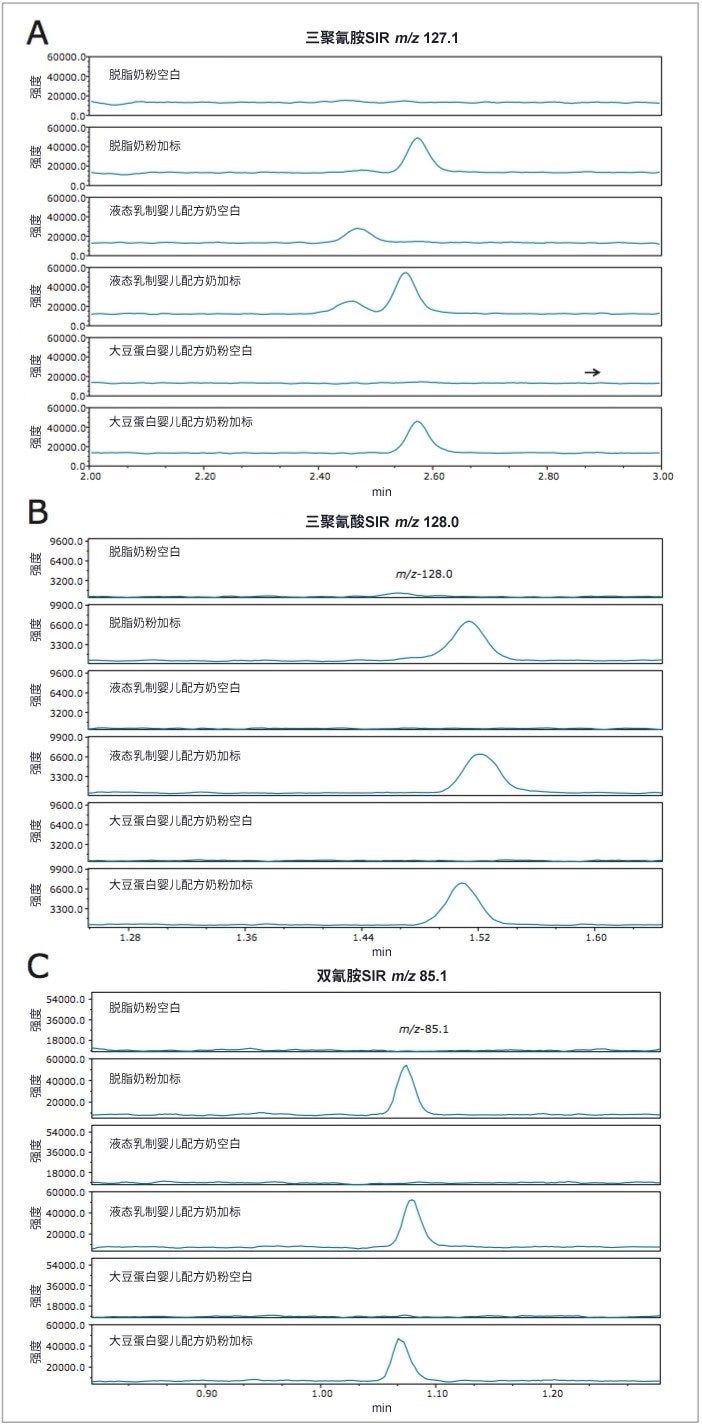
加标和不加标脱脂奶粉、液态乳制婴儿配方奶和大豆蛋白婴儿配方奶粉的分析结果比较如图6所示。三聚氰胺的加标浓度为1 mg/L,分析结果如图6A所示。三聚氰酸(图6B)和DCD(图6C)的加标浓度为20 mg/L(在图5所示的校准范围内)。乳制婴儿配方奶粉样品的三聚氰胺峰(保留时间2.5 min,图6A)之前有一个明显的低浓度峰,但不会干扰三聚氰胺峰的积分。
为了评估方法的回收率,我们将加标量与使用图5中的校准曲线定量计算得到的加标量进行了对比。5种不同基质的回收率列于表2中,基质加标浓度如前文所述。所有分析物的回收率均在75% ~ 123%范围内。我们通过7次进样加标的液态大豆蛋白婴儿配方奶进行了重现性评估,每种分析物的保留时间和含量的RSD%如表2所示。
本实验开发了一种可快速筛查婴儿配方奶粉中的三聚氰胺、三聚氰酸和双氰胺的方法。在本实验所研究的5种加标基质中,3种目标分析物的回收率均在75% ~ 123%范围内。本研究采用配备ACQUITY QDa检测器和BEH Amide色谱柱填料的ACQUITY UPLC H-Class系统,实现了:
720005397ZH,2017年10月