本应用纪要介绍了一种采用通用试剂盒纯化方案的分析方法,该方法能够准确、可靠地定量血浆中内源性CRP的浓度。得益于LC-MS动态范围宽、专属性高的优势,低浓度内源性CRP以及患者体内可能存在的高浓度CRP都能实现可靠测定。
实现蛋白质生物标志物的高灵敏度定量分析;采用基于通用试剂盒的方案进行蛋白质定量,分析速度快、重现性佳;Xevo TQ-XS质谱仪带来高灵敏度优势;应用混合模式SPE的样品制备方案具有高专属性,无需亲和纯化操作。
C-反应蛋白(CRP)1在肝脏中天然合成,并作为炎症响应因子被释放到血液中。因此,通过测定CRP来诊断类风湿性关节炎(RA)2,4等慢性炎症以及评估心血管疾病风险3和炎性癌变过程4的方法受到广泛关注。组织损伤或炎症会使血浆CRP浓度升高100倍以上2。健康个体的内源性血浆CRP浓度相对较低,一般为0.1~3 µg/mL (4~120 nM)2,但患者体内的CRP浓度却高出许多,要实现准确定量,需要使用多重ELISA或比浊免疫法3。由于需要进行多重测试,样品浓度范围往往会超出配体结合试验(LBA)方法的线性动态范围。除了这一固有劣势之外,还有很多其它原因促使业界逐渐转向采用LC-MS方法,例如缺乏标准化方法、可能发生交叉反应、成本高昂、难以保证试剂配制的一致性等等,而这些只是众多原因中的一小部分。质谱检测在蛋白质定量方面拥有诸多优势,如灵敏度高、专属性高、线性动态范围宽、方法开发速度快以及可进行多重分析等。不过,蛋白质的LC-MS定量方法仍然面临许多难题。目前这种方法还没有形成一套标准化的工作流程,而现有的各种工作流程往往复杂又繁琐,使得科学家们难以成功完成分析。本应用纪要介绍了一种通用试剂盒方案,相较于文献中耗时长达24 h的标准方法5,该方法仅需2 h即可完成酶解。酶解和后续的肽纯化步骤采用ProteinWorks eXpress直接酶解试剂盒(部件号:176003688)和ProteinWorks µelution SPE净化试剂盒(部件号186008304)完成,以准确、可靠地定量人血浆中的内源性CRP。采用上述试剂盒及其随附的方案,我们仅使用35 µL血浆样品就达到了0.025~0.1 µg/mL (1~4 nM)的LLOQ。
向大鼠或人血浆中加标0.025~100 µg/mL (1~3987 nM)范围内的不同浓度CRP(人序列),以制备校准曲线标准品和质量控制(QC)样品。CRP QC样品为1批次大鼠血浆和4批次人血浆制备。每个浓度的校准曲线标准品重复制备两份,每个QC浓度的QC样品重复制备三份,空白(不加标)血浆样品则重复制备四份。使用ProteinWorks eXpress直接酶解试剂盒并专门按照试剂盒随附的3步方法(无需还原/烷基化步骤)酶解血浆样品(35 µL) 2 h,变性时间则缩短为5 min(部件号:176003688)。酶解之后,使用ProteinWorks µElution SPE净化试剂盒(部件号:186008304)以及随附的方案纯化特征性肽段。
|
LC系统: |
ACQUITY UPLC |
|
色谱柱: |
ACQUITY UPLC HSS T3, 1.8 μm, 2.1 x 50 mm |
|
温度: |
55 °C |
|
样品温度: |
10 °C |
|
进样体积: |
5 μL |
|
流动相: |
A:0.1%甲酸水溶液 B:0.1%甲酸的乙腈溶液 |
|
时间(min) |
流速(mL/min) |
%A |
%B |
曲线 |
|---|---|---|---|---|
|
初始 |
0.3 |
100 |
0 |
6 |
|
1 |
0.3 |
100 |
0 |
6 |
|
5 |
0.3 |
70 |
30 |
6 |
|
5.5 |
0.3 |
10 |
90 |
6 |
|
6.3 |
0.3 |
10 |
90 |
6 |
|
6.4 |
0.3 |
100 |
0 |
6 |
|
7.5 |
0.3 |
100 |
0 |
6 |
|
MS系统: |
Xevo TQ-XS |
|
电离模式: |
ESI+ |
|
毛细管电压: |
3.5 kV |
|
电离源补偿(V): |
60 V |
|
离子源温度: |
150 °C |
|
脱溶剂气温度: |
600 °C |
|
锥孔气流速: |
150 L/h |
|
脱溶剂气流速: |
1000 L/h |
|
碰撞气流速: |
0.15 mL/Min |
|
喷雾器气流: |
7 bar |
|
数据管理: |
MassLynx 4.1版;TargeLynx |
尽早检出浓度升高的CRP对于RA或心脏病的正确治疗和预防至关重要。 能够检出低浓度CRP并区分其微小浓度差异的高灵敏度分析方法将有助于CRP的早期检出。质谱检测法虽然并非CRP定量的传统方法,但该方法拥有足够的灵敏度和重现性,能够准确测定健康个体的低浓度内源性CRP以及患病群体的高浓度CRP。
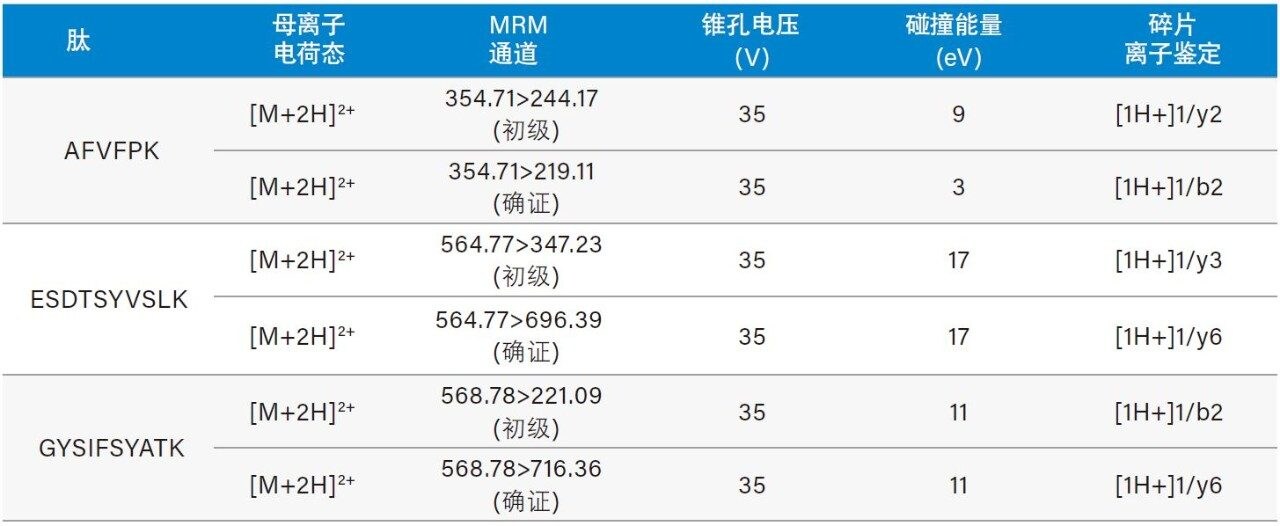
蛋白质的LC-MS定量分析方法通常采用“自下而上”方案,即首先对蛋白质进行酶解(一般使用胰蛋白酶),然后分析酶解所得的肽(胰蛋白酶肽)。为了确定合适的人CRP(图1)代表性或特征性肽段,我们使用Skyline软件(华盛顿大学MacCoss实验室)进行了模拟酶解6。除了能确定可能生成的胰蛋白酶肽之外,Skyline还能选择和优化用于MRM(多重反应监测)分析的母离子和碰撞诱导解离碎片离子,从而协助MS方法开发。图2所示为CRP的完整氨基酸序列7及其独有的特征性肽段:AFVPFK、ESDTSYVSLK和GYSIFSYATK(以蓝色突出显示)。经过优化的CRP胰蛋白酶肽MS分析条件和MRM通道列于表1。每种肽均设有初级和确证(次级)通道。

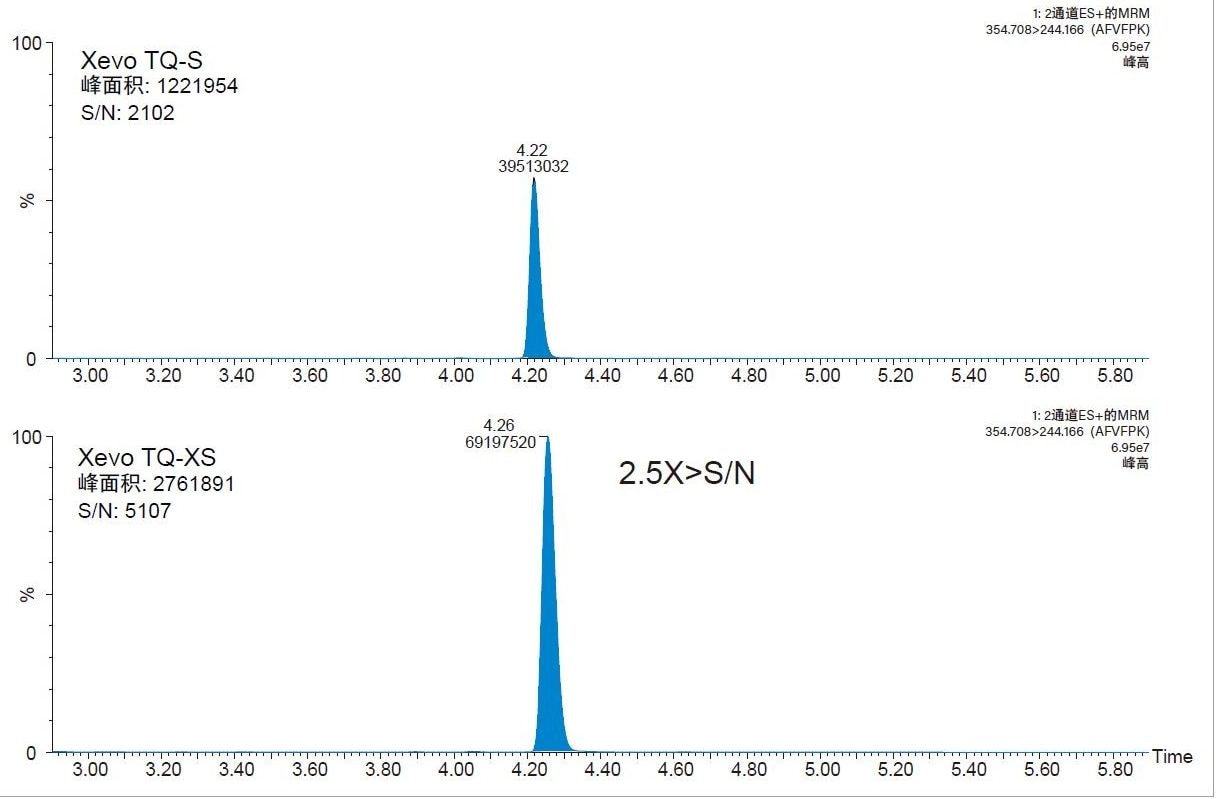
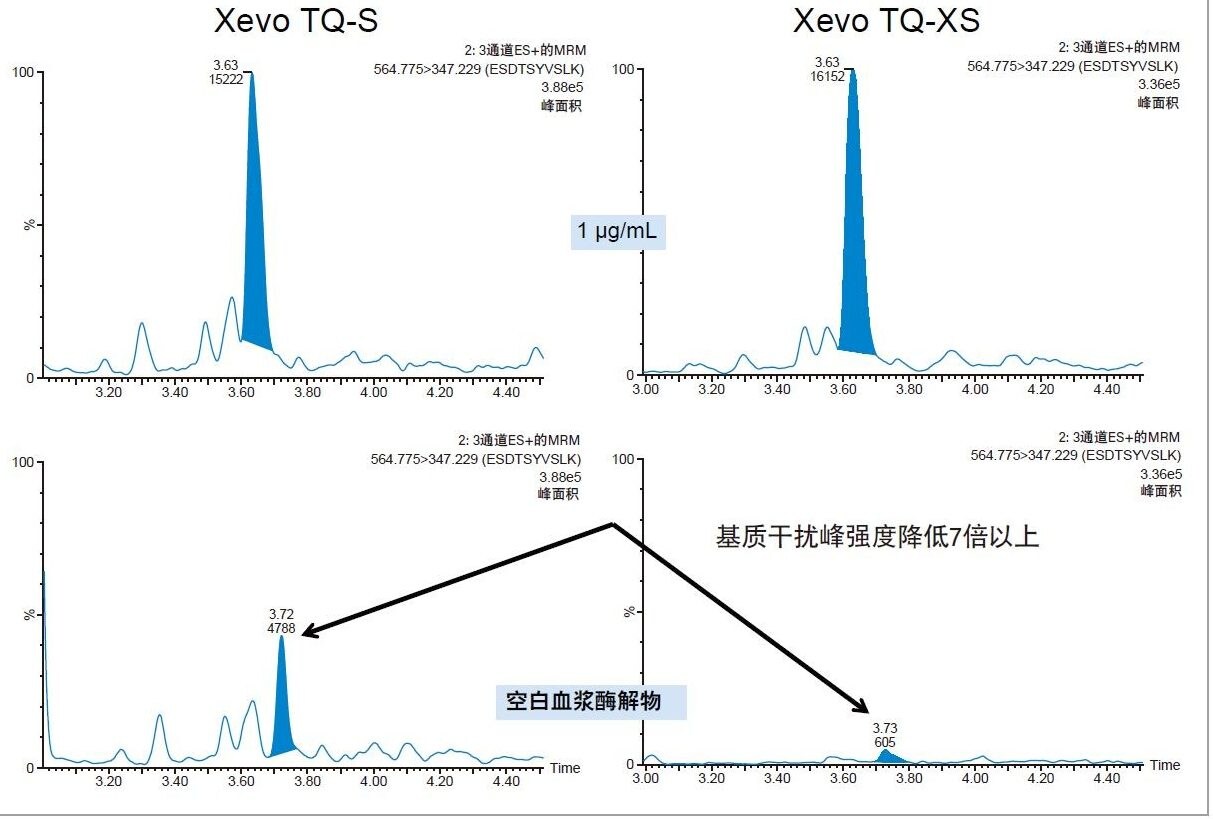
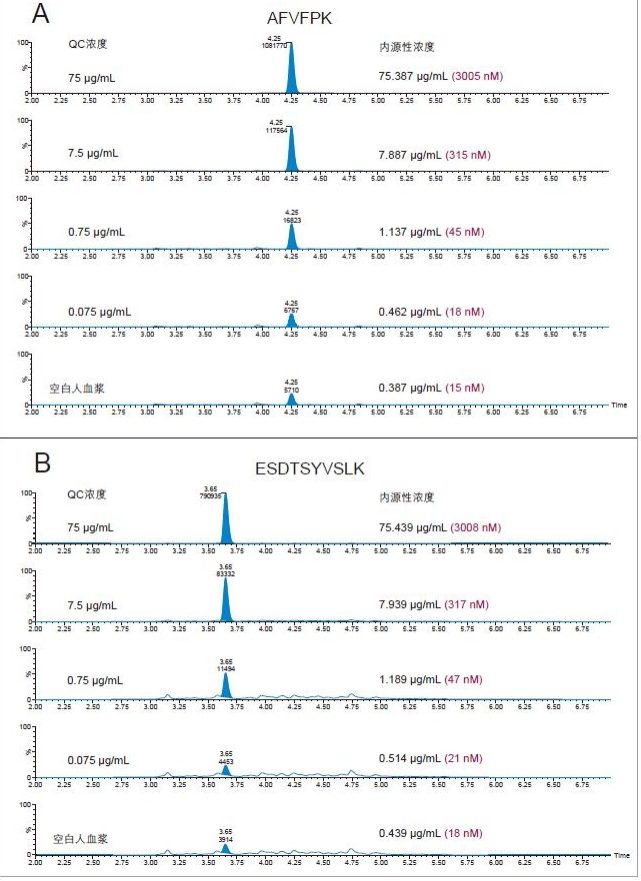
在一项早期研究中,我们使用Xevo TQ-S MS对CRP进行了定量分析。本研究将此定量方法转移到了灵敏度更高的新一代平台:Xevo TQ-XS三重四极杆质谱仪。与之前的平台相比,使用Xevo TQ-XS分析三种定量用CRP肽的信噪比(S/N)分别提升了2.5倍(AFV)、3.5倍(ESD)和1.4倍(GYS)。AFV肽检测灵敏度的提升如图3所示。对于ESD肽(RT 3.63 min),表现为主峰肩峰的干扰基质峰(RT 3.72 min)强度降低了7倍,如图4所示。基质干扰的降低有利于峰积分和优化检测限。
由于胰蛋白酶肽分子小且极性强,其在反相色谱柱上的保留性较差。本研究使用ACQUITY HSS T3, 1.8 µm, 2.1 x 50 mm色谱柱(部件号:186003538)分离CRP肽,相较于BEH C18色谱柱,这款色谱柱更经济,对胰蛋白酶肽的保留性更强,还有助于提高目标肽与内源性基质干扰峰之间的分离度。三种肽(AFVPFK、ESDTSYVSLK和GYSIFSYATK)的代表性色谱图如图5所示。峰宽均< 4.5 s。
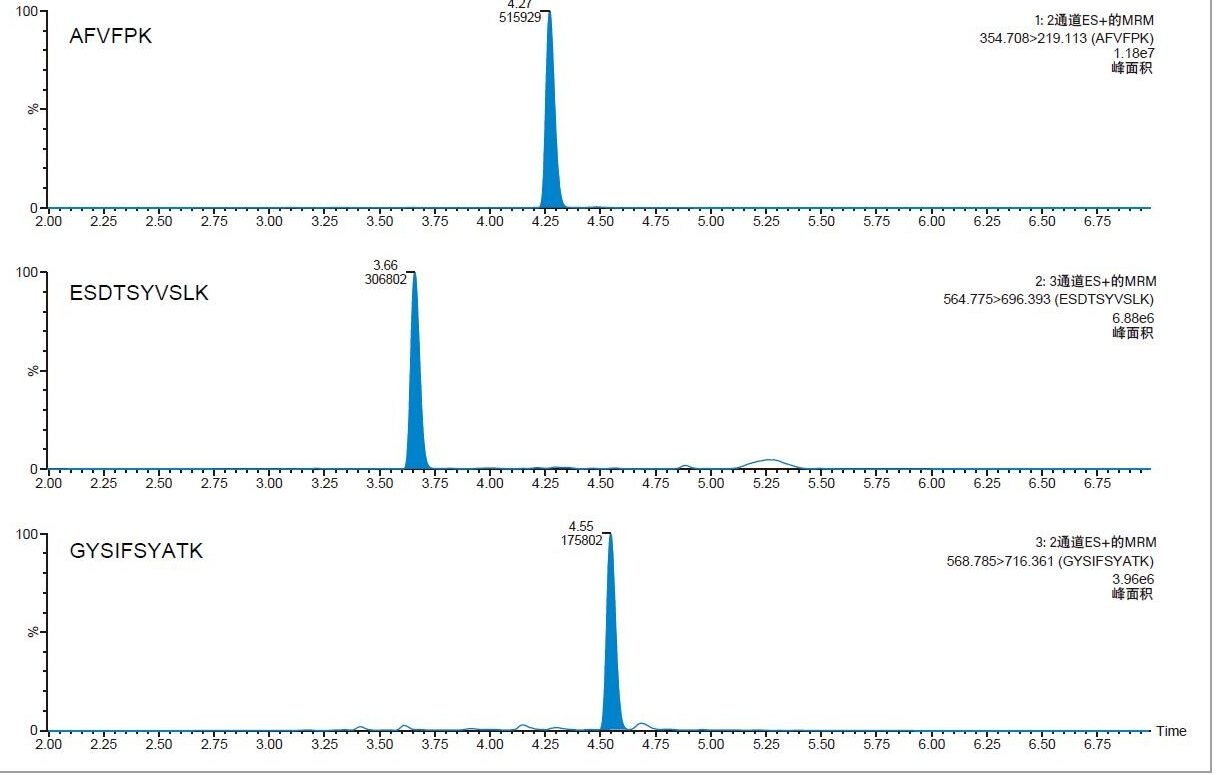
蛋白质定量分析的常规样品制备工作流程通常较为复杂和繁琐。本研究使用ProteinWorks eXpress直接酶解试剂盒(部件号:176003688)直接酶解血浆样品,仅需2 h即可完成酶解。酶解之后,使用ProteinWorks µElution SPE净化试剂盒(部件号:186008304)及随附的方案去除缓冲盐、磷脂和过量的酶解试剂。SPE试剂盒采用混合模式吸附剂(Oasis MCX,反相和离子交换吸附剂),专属性极高。胰蛋白酶肽将结合至SPE吸附剂的离子交换区域,因此可从整体上赋予方法正交性并提升其专属性。此外,相较于仅含传统反相填料的吸附剂,离子交换吸附剂能够更高效地保留强极性肽。这一点对于成功保留极性最强的ESD肽尤为重要。使用本文所述的通用方案,全部三种CRP肽的回收率都非常出色(回收率≥ 90%)。
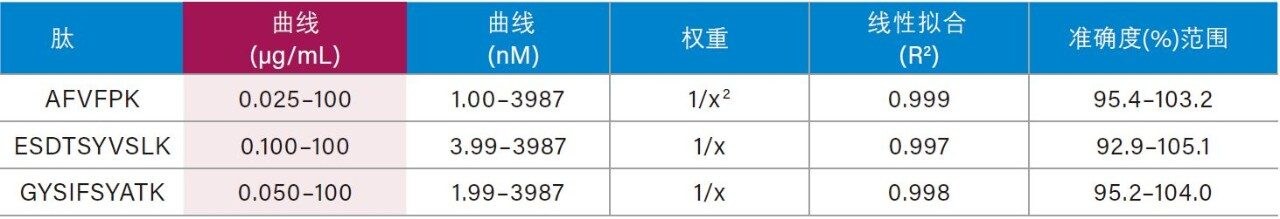
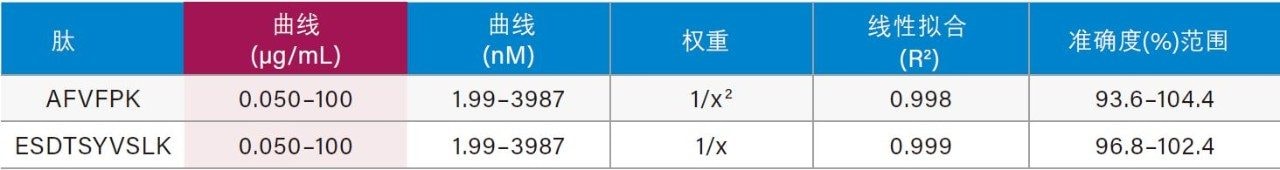
仅使用35 µL样品和前文所述的ProteinWorks试剂盒,大鼠和人血浆中CRP的定量限分别达到了0.025和0.05 µg/mL (1~2 nM)。大鼠和人血浆中胰蛋白酶肽的校准曲线均呈线性(R2值> 0.99,使用1/x或1/x2加权回归)。大鼠和人血浆的标准曲线性能汇总如表2和表3所示。线性、准确度和精度均符合典型的方法验证要求。大鼠和人血浆的标准曲线在4个数量级范围内均呈线性,而且平均准确度达94%~105%。所有QC样品的精度和准确度都非常出色,平均%RSD均小于5%,并且QC准确度(%)达94.3~106.2(大鼠血浆)和89.4~103.5(人血浆)。表4展示了大鼠血浆QC样品检测结果的统计数据。人血浆QC样品中AFV和ESD肽检测结果的统计数据分别如表5的A表和B表所示。上述检测结果对应的色谱图如图6中的A图和B图所示。
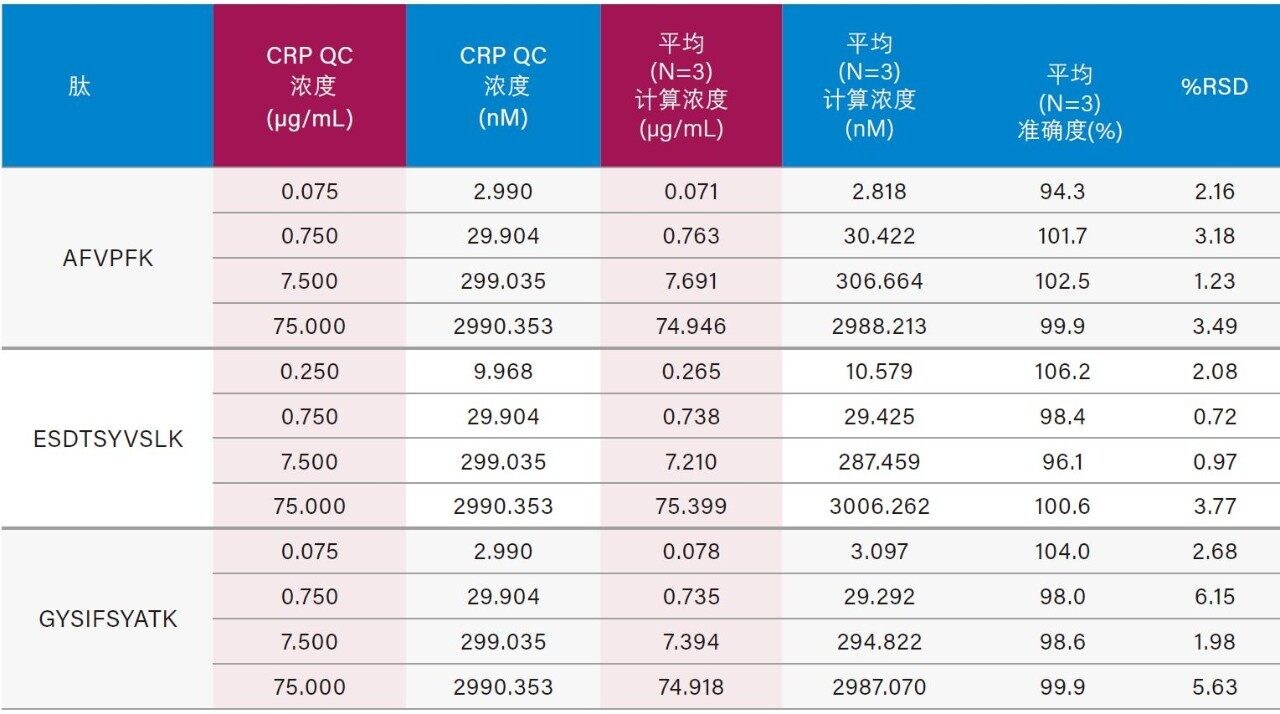
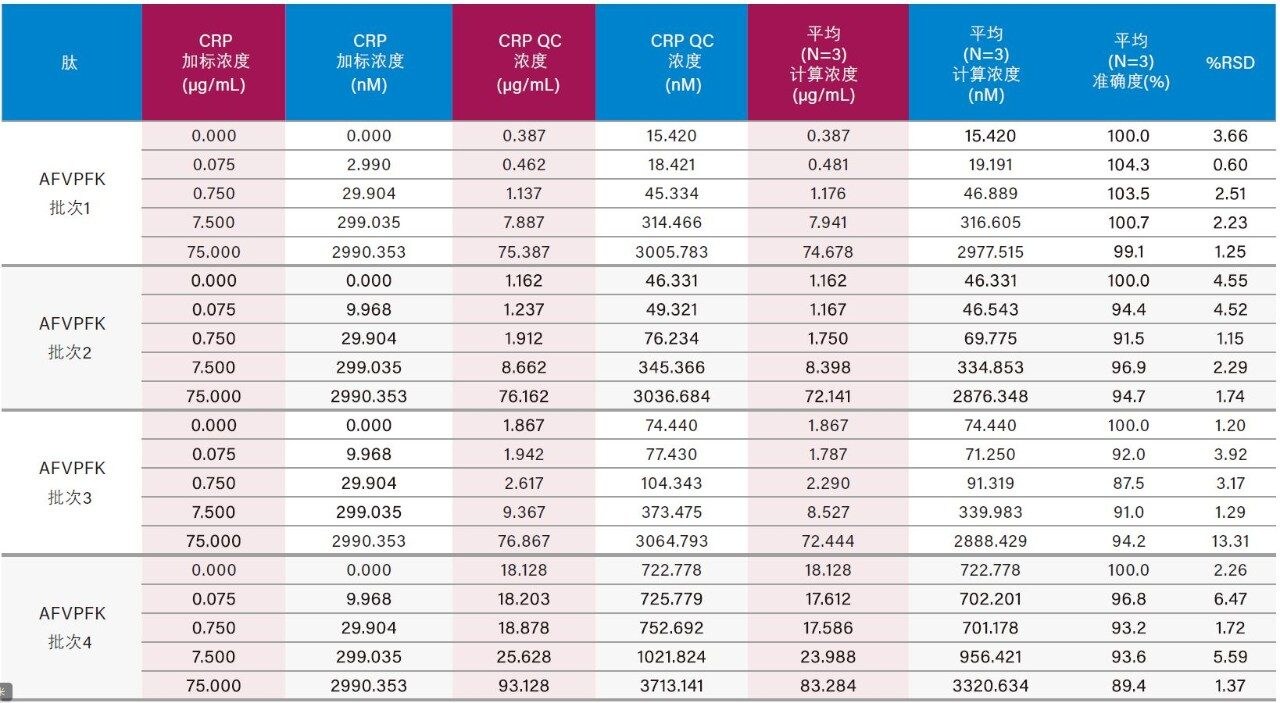
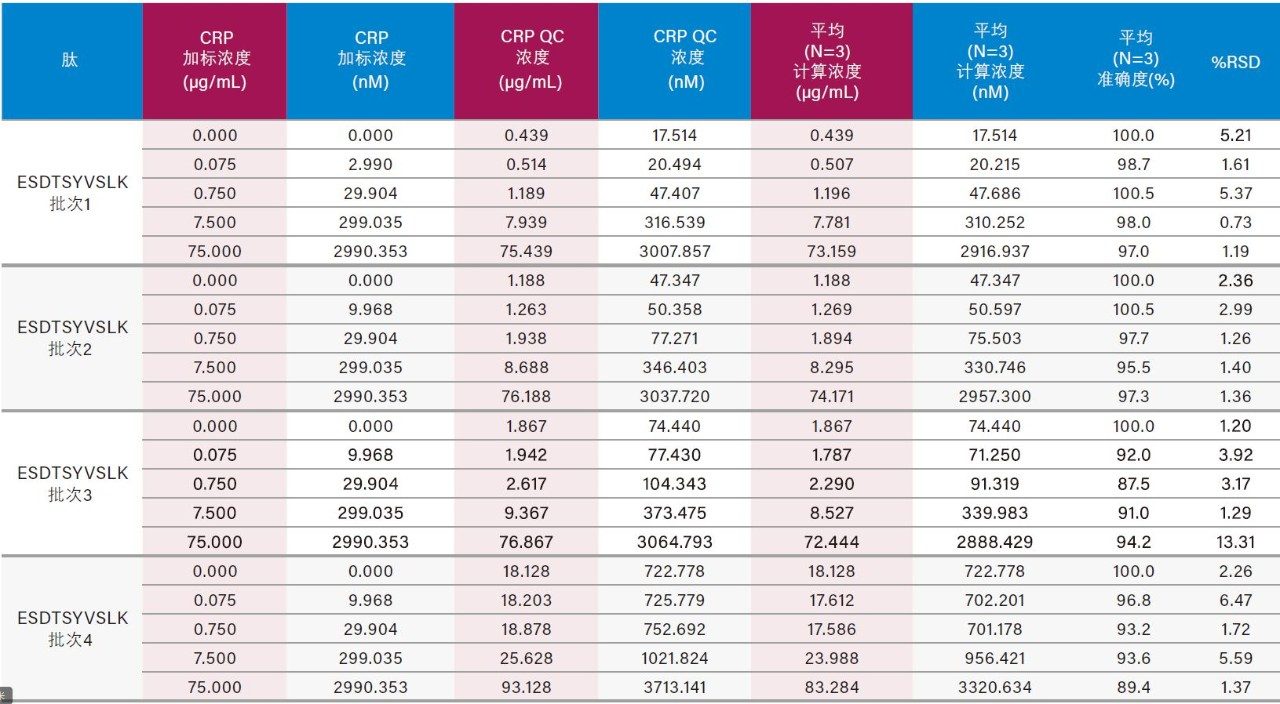
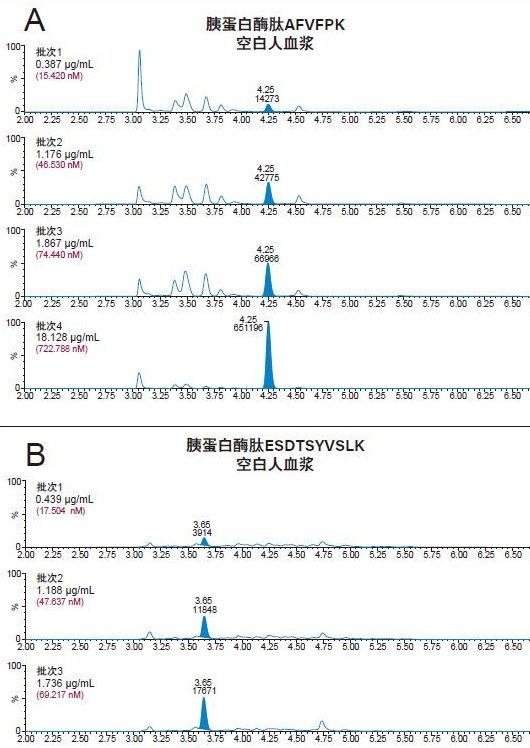
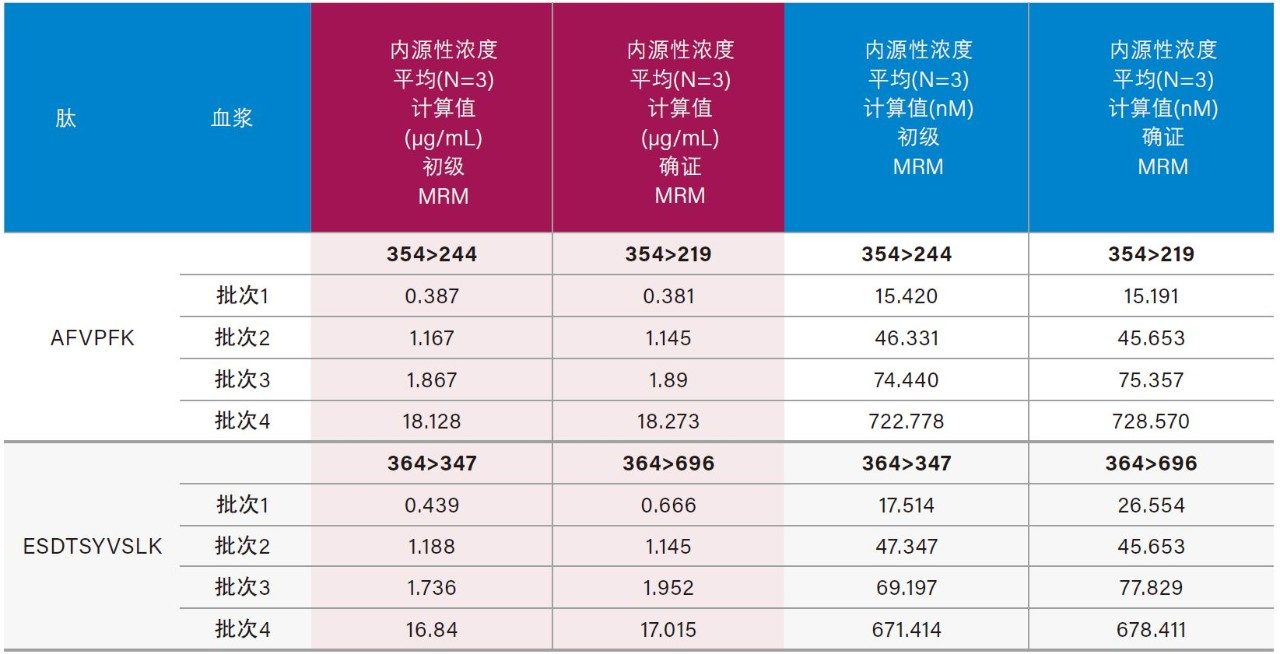
4批次人血浆中内源性人CRP的浓度均得到了准确定量。在高于人血浆内源性浓度的情况下,可精准定量的CRP最低浓度为0.05 µg/mL (2 nM)。在空白人血浆酶解物的色谱图中(图6),由于内源性CRP浓度可达0.4~0.666 µg/mL,因此存在较强的人CRP肽信号。大鼠空白血浆酶解物中(图4)未检出人CRP肽,这一点符合预期,因为大鼠CRP的氨基酸序列与人CRP序列不同。4批次人血浆中内源性CRP的浓度计算结果汇总于表6中,对应的色谱图如图7中的A图(AFV肽)和B图(ESD肽)所示。对于各批次的血浆,根据胰蛋白酶肽AFV或ESD计算得到的内源性CRP浓度一致(相差不超过10%)。采用各种肽的确证通道验证了每批次血浆样品的内源性浓度。 除批次1之外,根据初级和确证通道计算所得的浓度之间的偏差都不超过10%。根据GYS肽计算出的内源性CRP浓度与根据AFV和ESD肽计算出的结果不吻合。推测其原因可能是潜在共洗脱干扰物影响了基于GYS肽结果进行定量的准确性。
本研究使用市售酶解和纯化试剂盒对浓度低至0.025 µg/mL (1 nM)的内源性CRP进行了可靠定量。采用试剂盒随附的方案对血浆样品(35 µL)进行直接酶解(无需亲和纯化步骤)并完成了后续的胰蛋白酶肽纯化。将混合模式SPE与上述方案配合使用,三种肽的回收率都达到90%以上。包括SPE在内的总样品制备时间不超过3 h。将Xevo TQ-S MS平台升级为Xevo TQ-XS提高了分析灵敏度和信噪比,进而改善了LOQ。实验结果表明,这种采用通用试剂盒纯化方案的分析方法可准确、可靠地定量血浆中的内源性CRP浓度。得益于LC-MS动态范围宽、专属性高的优势,低浓度内源性CRP以及患者体内可能存在的高浓度CRP都能实现可靠测定。
720005819ZH,2016年10月