在本应用纪要中,我们将RapiFluor-MS与UPLC-FLR-MS相结合,用于监测特性、质量和相对丰度各不相同的标记游离寡糖。
糖基化修饰是大多数治疗性蛋白质既复杂又关键的一个方面,我们必须对其进行准确表征。一般来说,N-糖谱图都被视作一项关键品质属性,因此是整个产品生命周期中都要监测的一项属性。如本应用纪要所述,利用GlycoWorks RapiFluor-MS N-糖分析试剂盒制备样品可大大缩短样品制备时间并简化制备过程。
此外,采用RapiFluor-MS可获得更高的FLR灵敏度,同时大幅提升MS灵敏度。得益于RapiFluor-MS标记技术对游离寡糖MS检测灵敏度的提升,分析人员现在可以应用ACQUITY QDa进行质谱检测,从而提升在生物制药开发过程中对各种结构进行峰监测时的可信度。
总而言之,RapiFluor-MS标记与通过ACQUITY UPLC H-Class Bio系统和ACQUITY QDa质谱检测器实现的HILIC-FLR-MS检测相结合,为监测生物治疗药物的N-糖谱图提供了一套卓越的解决方案。
糖基化修饰是蛋白类生物治疗药物最复杂的翻译后修饰之一。糖基化治疗药物的疗效与糖基化分布直接相关。多余的结构可能会对药物的PK/PD特性产生有利或不利的影响,而且与免疫反应相关。因此,糖基化修饰通常被视为一项关键品质属性(CQA)。在药物开发过程中,我们要对候选分子的糖基化分布进行深入研究和表征。然后在整个工艺开发、产品商业化以及批准后研究中对药物特征进行监测,以确保产品疗效和安全性。
本应用纪要介绍了一种利用RapiFluor-MS标记游离N-糖并采用配备荧光(FLR)检测器和ACQUITY QDa质谱检测器的ACQUITY UPLC H-Class Bio系统分析标记N-糖的精简方法。采用这一全新的监测工作流程,研究人员在30 min内即可完成UPLC-FLR/MS分析的糖蛋白样品制备过程。 除了能够缩短样品制备时间,RapiFluor-MS与2-AB相比,能够将荧光响应提高14倍,同时将MS响应提高160倍。这些改进使得研究人员能够将FLR检测和通过ACQUITY QDa实现的质谱检测应用到常规分析中。在本应用纪要中,我们将RapiFluor-MS与UPLC-FLR-MS相结合,用于监测特性、质量和相对丰度各不相同的标记游离寡糖。
|
LC系统: |
ACQUITY UPLC H-Class Bio |
|
检测器: |
ACQUITY UPLC FLR检测器和ACQUITY QDa质谱检测器 |
|
色谱柱: |
ACQUITY UPLC Glycan BEH Amide, 130Å, 1.7 μm, 2.1 x 150 mm |
|
柱温: |
60 °C |
|
样品温度: |
10 °C |
|
进样体积: |
2 μL |
|
数据管理: |
Empower 3 FR2 CDS |
|
数据采集速率: |
5 pts/s |
|
激发波长: |
265 nm |
|
发射波长: |
425 nm |
|
采样速率: |
5 pts/s |
|
质量范围: |
500~1250 Da |
|
锥孔电压: |
15 V |
|
毛细管电压: |
1.5 kV |
|
探头温度: |
500 °C |
|
电离模式: |
ESI+ |
|
流动相A: |
乙腈(Pierce,LC-MS级) |
|
流动相B: |
50 mM甲酸铵,pH 4.4(LC-MS级,沃特世甲酸铵浓缩液) |
|
流动相C: |
乙腈(LC-MS级) |
|
流动相D: |
乙腈(LC-MS级) |
|
时间 |
流速(mL/min) |
%A |
%B |
%C |
%D |
|---|---|---|---|---|---|
|
初始 |
0.4 |
75 |
25 |
0 |
0 |
|
35 |
0.4 |
54 |
46 |
0 |
0 |
|
36.5 |
0.2 |
0 |
100 |
0 |
0 |
|
39.5 |
0.2 |
0 |
100 |
0 |
0 |
|
42.5 |
0.2 |
75 |
25 |
0 |
0 |
|
47.4 |
0.4 |
75 |
25 |
0 |
0 |
|
55 |
0.4 |
75 |
25 |
0 |
0 |
使用随附于GlycoWorks RapiFluor-MS N-糖分析试剂盒(部件号176003606)中的沃特世完整单克隆抗体质量数检查标准品(部件号186006552)制备小鼠IgG1 mAb N-糖样品。另外,使用核糖核酸酶B和牛胎球蛋白(Sigma Aldrich)制备N-糖样品。使用GlycoWorks RapiFluor-MS N-糖分析试剂盒,按照《维护和使用手册》(715004793)中提供的方案制备游离和标记N-糖混合样品。完成释放和标记步骤之后,使用CentriVap干燥样品,并复溶于25 µL乙腈/水/DMF混合物中(比例为22.5%:55.5%:22%)。每个示例中,目标载样量均为30 pmol游离寡糖。使用沃特世甲酸铵浓缩液(部件号186007081)配制甲酸铵流动相。
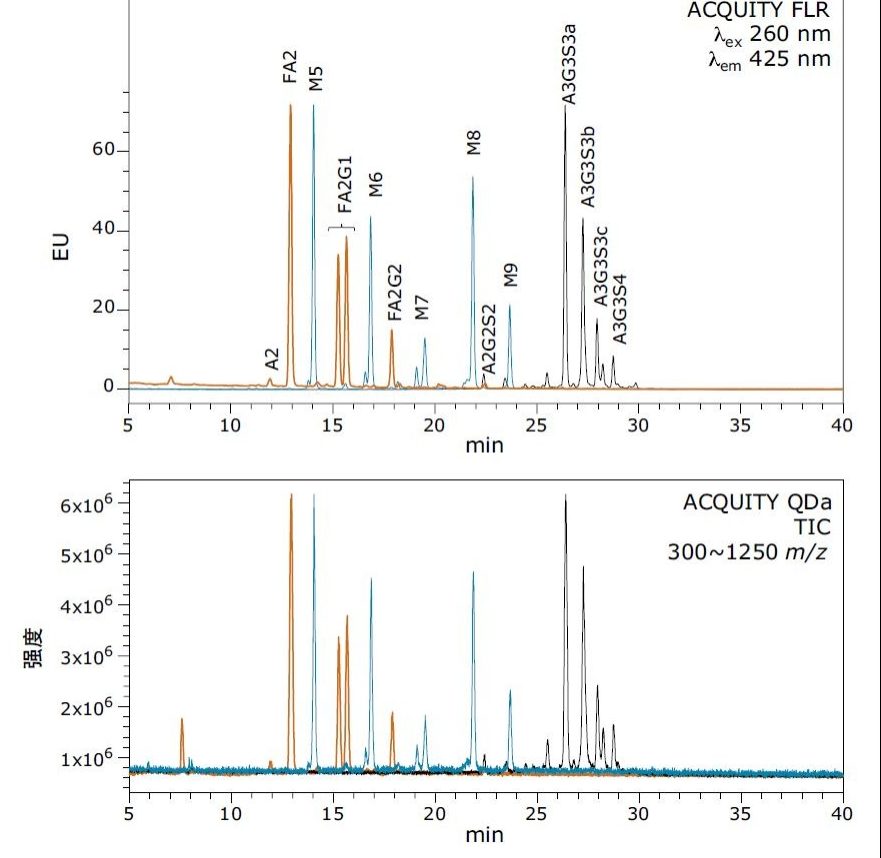
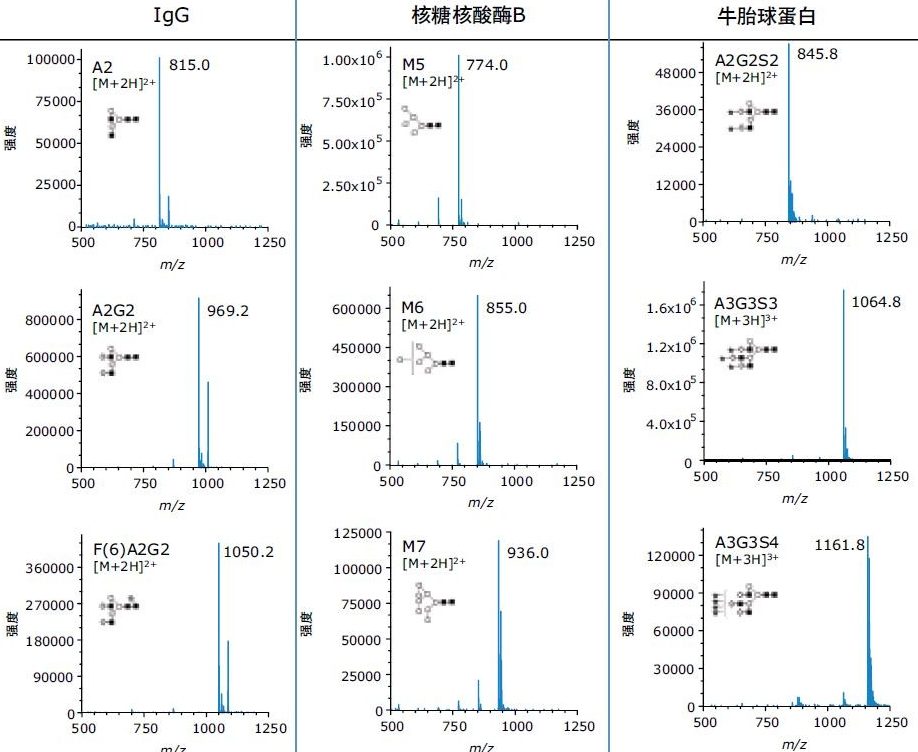
N-糖基化修饰根据蛋白质和表达系统不同,可产生大小、电荷和支化程度不同的多种游离寡糖结构。为了评估ACQUITY QDa检测质量范围以内及超出其质量范围的游离寡糖的能力,我们选择了三种糖蛋白(人源IgG、核糖核酸酶B和牛胎球蛋白),代表从中性双天线结构到四唾液酸化结构的常见游离寡糖。使用Rapid PNGase F释放各种蛋白质的N-糖,并按照试剂盒提供的样品制备方案用RapiFluor-MS标记样品。通过UPLC-HILIC分离标记的游离寡糖,并使用ACQUITY FLR和ACQUITY QDa两种检测器进行检测。
由图1可以明显看出,采用单一梯度方法就使得所有游离寡糖结构成功实现了色谱分离。 此外,在荧光检测谱图(上图)中观察到的所有游离寡糖结构都能在ACQUITY QDa质谱检测器谱图(下图)中观察到,说明ACQUITY QDa能够检测结构和属性各不相同的多种RapiFluor-MS标记游离寡糖,而电离效率较低的传统标记技术是无法获得这样的结果的。
利用质谱检测能够观察到游离寡糖结构这一点固然有用,了解所得谱图的质量以及谱图中游离寡糖离子的电荷态也十分重要。为了掌握这方面的信息,我们对特性各异的多个游离寡糖峰进行了积分,并使用FLR积分数据测定了每个样品中不同物质的相对丰度。图2所示的谱图证明,ACQUITY QDa能够为特性和质量不同的多种游离寡糖结构生成高质量谱图。该数据还证明,高丰度及低丰度游离寡糖结构均可轻松检出。我们的数据表明,即使是荧光谱图中丰度低至0.5%的结构,ACQUITY QDa质谱检测也可生成高质量谱图,展现了ACQUITY QDa质谱检测与RapiFluor-MS的高电离效率优势相结可实现的灵敏度提升。另外利用RapiFluor-MS游离寡糖结构的电荷态,可以使小型结构(如A2)以及极大型的结构(如四唾液酸化A3G3S4)被QDa顺利检出。
糖基化修饰是大多数治疗性蛋白质既复杂又关键的一个方面,我们必须对其进行准确表征。一般来说,N-糖谱图都被视作一项关键品质属性,因此是整个产品生命周期中都要监测的一项属性。如本应用纪要所述,利用GlycoWorks RapiFluor-MS N-糖分析试剂盒制备样品可大大缩短样品制备时间并简化制备过程。此外,采用RapiFluor-MS可获得更高的FLR灵敏度,同时大幅提升MS灵敏度。得益于RapiFluor-MS标记技术对游离寡糖MS检测灵敏度的提升,分析人员现在可以应用ACQUITY QDa进行质谱检测,从而提升在生物制药开发过程中对各种结构进行峰监测时的可信度。总而言之,RapiFluor-MS标记与通过ACQUITY UPLC H-Class Bio系统和ACQUITY QDa质谱检测器实现的HILIC-FLR-MS检测相结合,为监测生物治疗药物的N-糖谱图提供了一套卓越的解决方案。
720005353ZH,2015年3月