
このアプリケーションノートでは、C3:0~C18:0 の遊離脂肪酸の分離を実証しています。
Atlantis PREMIER BEH C18 AX カラムは遊離脂肪酸の分析において良好な分離を実現します。
脂肪酸は生物学的システムおよび微生物叢発酵の一部として食物に含まれており、ほ乳類のエネルギー貯蔵や細胞壁の成分として重要な役割を担っています¹。脂肪酸の分析方法はガスクロマトグラフィー²(ただしカルボン酸部位の誘導体化が必要)、液体クロマトグラフィー³(逆相モード)、超臨界流体クロマトグラフィー⁴など様々な方法が知られています。この資料では陰イオン交換-逆相ミックスモード固定相を充塡した Atlantis PREMIER BEH C18 AX カラムによる遊離脂肪酸の分離をご紹介します。
Atlantis BEH C18 AX カラムはエチレン架橋ハイブリッド(BEH)シリカパーティクルに C18 基と第三級アルキルアミン基を結合した固定相を充塡しています⁵。pH 8.0 以下では固定相表面は正電荷を帯びており、酸などの陰イオン性分子に対してイオン交換能を示します。脂肪酸の混合標準品(GLC-412、Nu-Chek Prep, Inc. より購入)にプロピオン酸(Sigma-Aldrich より購入)10 μL を加え、メタノール/クロロホルム混液(3/1, v/v)にて 1 mL としたのち、これをさらにメタノールで 100 倍希釈して試料溶液としました。
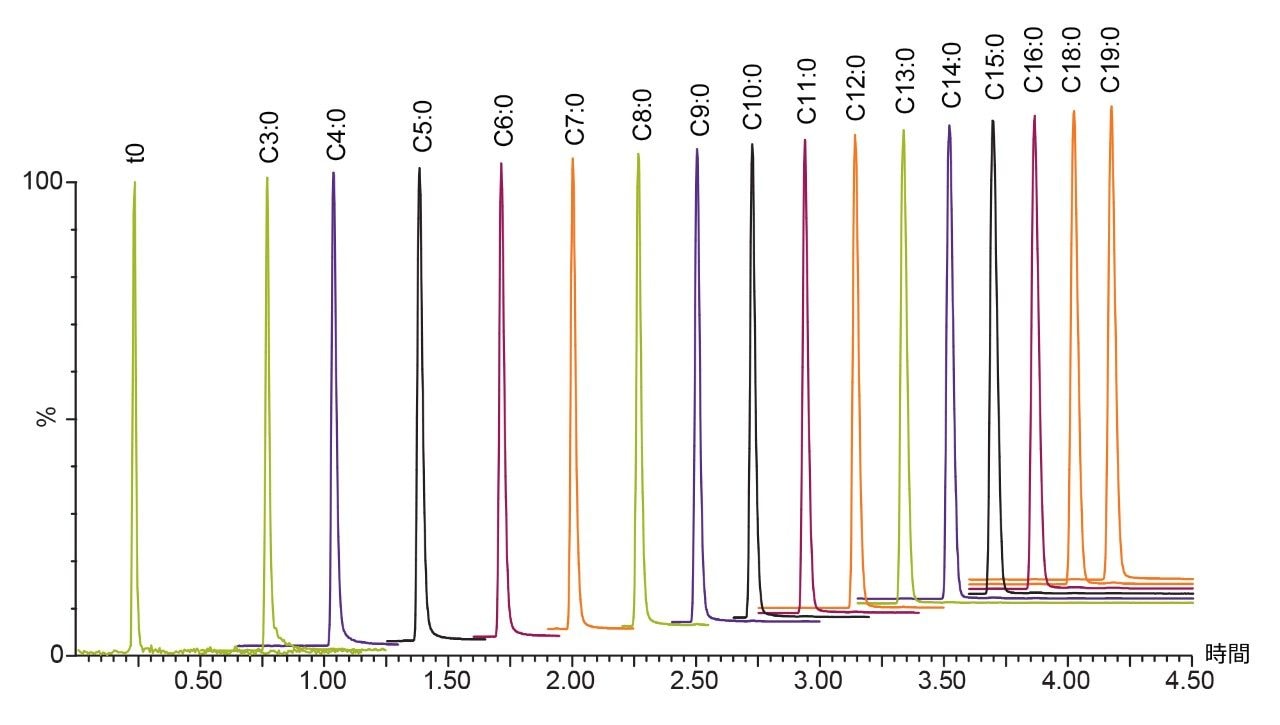
1 mM ギ酸アンモニウム水溶液(pH 3.0)を移動相 A、アセトニトリル/イソプロパノール混液(50/50, v/v)に 1 mM の濃度でギ酸アンモニウムを添加したものを移動相 B とし、6 分で B の組成が 0 から 100% になるようグラジエントを設定しました(曲線 5 を使用)。流量は 0.6 mL/min、カラム温度は 60°C、サンプル注入量は 3 μL としました。図 1 のクロマトグラムはプロピオン酸 (C3:0) からステアリン酸 (C18:0) までを分析したものです。プロピオン酸の保持係数 k’は 2.36 であり、炭素鎖が長くなるごとに k’ は大きくなります。移動相の pH は脂肪酸の pKa より低いためカルボン酸部位は解離せず、従って脂肪酸は C18 基との相互作用によって保持されます。
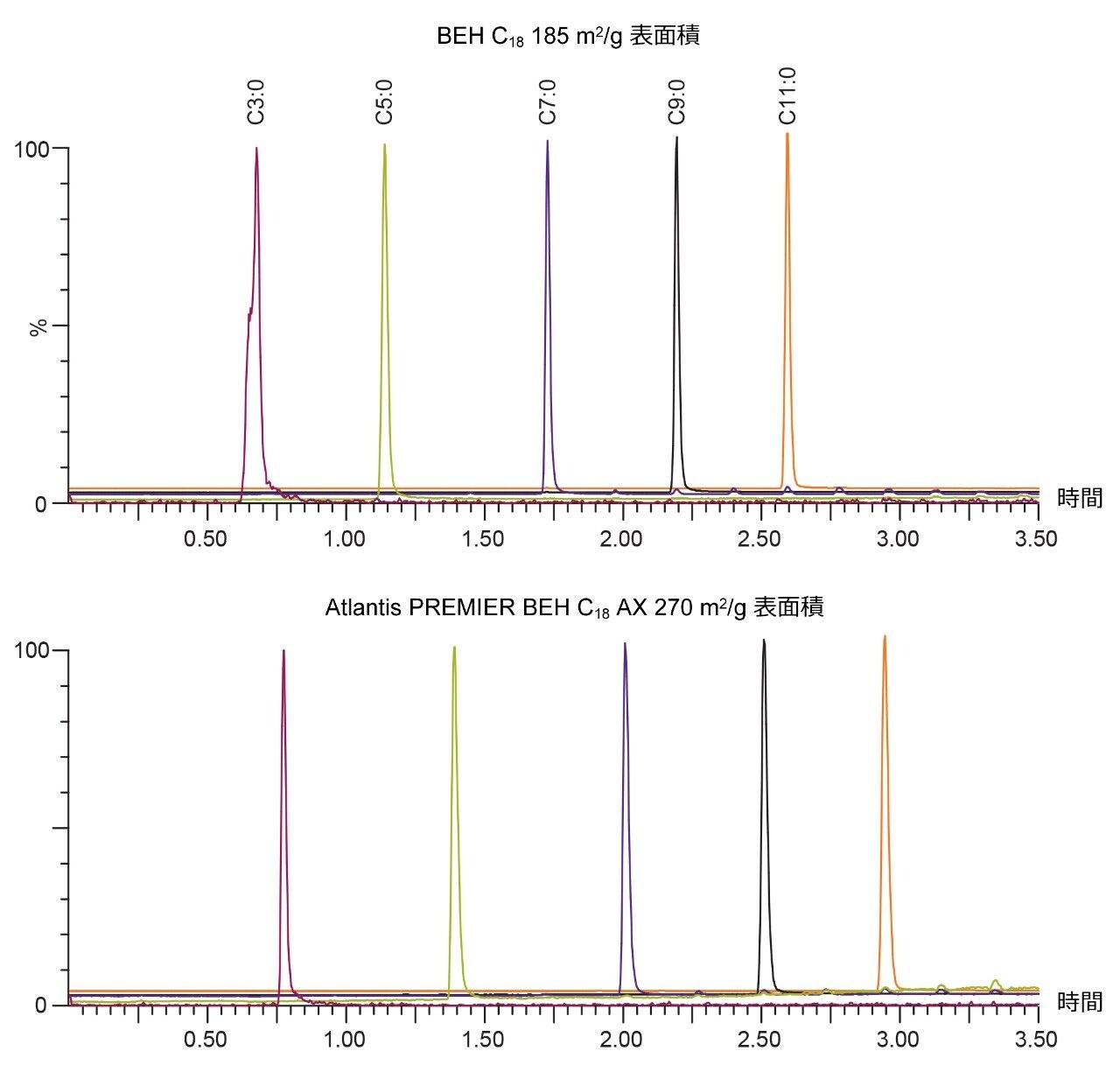
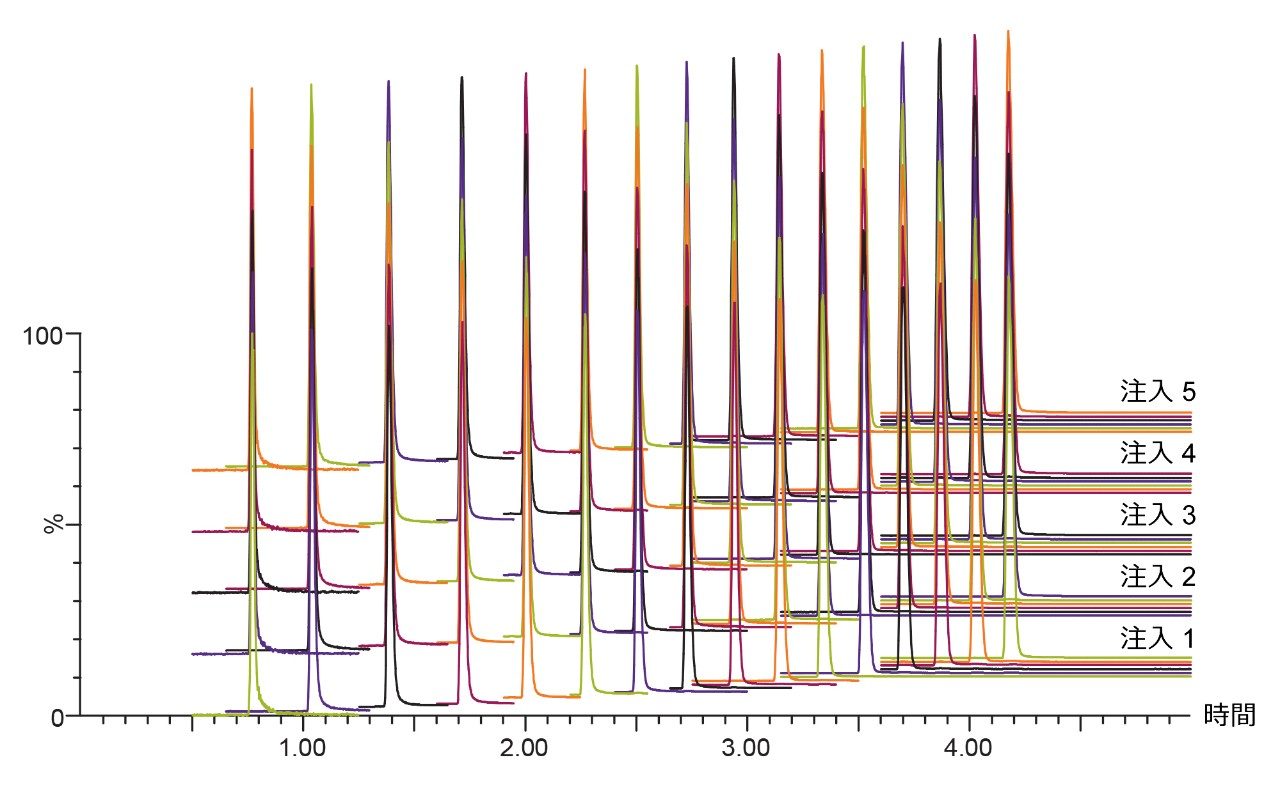
Atlantis BEH C18 AX で使用しているパーティクルの細孔径は 95 Å であり、他のカラムで使用している BEH パーティクルよりもポアサイズが小さくなっています⁵。ポアサイズを小さくすることによって表面積が大きくなり、固定相表面との相互作用が増えることで保持は強くなります。図 2 では Atlantis BEH C18 Ax(細孔径:95 Å、表面積:270 m²/g)と従来のBEH C18(細孔径:130 Å、表面積:185 m²/g)を用いて脂肪酸を分離した結果を比較しています。Atlantis BEH C18 AX では全体的に保持が強くなり、プロピオン酸 (C3:0) のピーク形状が改善しました。繰り返し再現性を確認するために試料溶液を複数回インジェクションし保持時間の相対標準偏差(RSD)を計算したところ 0.02~0.14% の範囲に収まりました(図 3 参照)。
Atlantis PREMIER BEH C18 AX カラムは遊離脂肪酸の分析において良好な保持と分離および保持時間の繰り返し再現性を示しました。
720006747JA、2020 年 1 月