定量および同定試験は、ワクチンの構成物および製品バッチのリリースにおける重要な部分です。従来のメソッドは選択性が低く、開発に時間がかかり、同時測定能力が不十分な場合があります。ガーダシル 9 は、9 種の異なる HPV L1 タンパク質抗原から構成される 9 価ワクチンで、子宮頸癌や性器周囲のいぼのリスク増大の原因となる HPV のサブタイプの広範な予防を提供します。本研究では、完全なサンプル前処理ワークフロー(アジュバント除去、トリプシン消化、LC-MS/MS 定量モニタリングを含む)を活用して、サロゲートペプチドメソッドによりガーダシル 9 の成分を測定しました。1 つの LC-MS/MS メソッドで、9 種の HPV 株特異的 L1 タンパク質すべてを 10 ~ 200 µg/mL の濃度範囲にわたって、高い再現性で同時に定量することができました。
ガーダシル 9 は、ウイルス様粒子(VLP)を構成する HPV L1 タンパク質抗原からなる 9 価のワクチンです。これらの抗原により、子宮頸がんの 80 ~ 90%、性器周囲のいぼの 90% を占める 9 種類の HPV 株が予防できます1,2。 ワクチン製造プロセスにおける重要なステップの 1 つに、ワクチン構成物および製品バッチの品質管理が挙げられます。バッチリリース検査には、例えば無菌性、効力、純度、抗原の定量、および同定試験などが含まれます。定量および同定試験の従来のメソッドには、総タンパク質量測定や ELISA などがあります。これらの分析法には、非特異性(または特異性不明や交差反応性)などの限界があり、開発に時間がかかる上に、同時測定能力が不十分です。このため、抗原の定量および同定試験のいずれにも、質量分析をツールとして利用するメリットがあります。質量分析により、サブタイプ特異的な L1 タンパク質の同時かつ選択的な測定および定量が可能になります。本研究では、アルミニウム塩のアジュバントからの HPV L1 タンパク質の脱離、およびサロゲートペプチドメソッドを用いたガーダシル 9 の HPV L1 抗原の定量のためのタンパク質のトリプシン消化を含む、完全なサンプル前処理ワークフローを開発しました。質量分析を含むこのワークフローにより、ガーダシル 9 ワクチン製品中に予想される HPV L1 タンパク質の濃度範囲 40~120 µg/mL を広くカバーする 10~200 µg/mL の範囲にわたって、これらのペプチドの再現性の高い定量が可能になりました。
各 HPV L1 タンパク質を 750 µg/mL(30 µg)に希釈し、RapiGest SF 界面活性剤(Waters、製品番号 186001861)で変性した後、ジチオスレイトールで還元し、ヨードアセトアミドでアルキル化しました。サンプルは、トリプシン:タンパク質比 1:10(w/w)でトリプシン(Promega、製品番号 V5111)消化し、ギ酸で反応を止めました。LC-MSE を用いたペプチドマッピングは、Xevo G2-XS QTof 質量分析計に接続した ACQUITY UPLC I-Class PLUS システムにサンプルを 10 µL 注入して行いました。
100 µg/mL のウシ血清アルブミン(Sigma、製品番号 05470)水溶液 16 µL に、ブランク、標準品、品質管理、またはワクチン製品の各サンプル 2 µL をそれぞれ添加しました。ブランクを除くすべてのサンプルに 2 µL の内部標準を添加しました。100 mM Tris HCl(pH 10.0)中に調製した 0.1%(w/v) RapiGest SF 界面活性剤(Waters、製品番号 186001861)20 µL を各サンプルに添加しました。サンプルを 80℃ で 10 分間インキュベートし、2000 × g で 5 分間遠心分離してアジュバントをペレット化しました。32 µL のサンプルをペレット化したアジュバントから慎重に採取し、1.2 µL の 10% 塩酸(v/v)で pH 8.0 に中和しました。サンプルは、0.3 µg のトリプシン(Promega、製品番号 V5111)を用いて(トリプシン:タンパク質比 1:10)、37℃ で一晩消化しました。消化反応を停止し、2 µL の 20% ギ酸水溶液(v/v)を用いて 37℃ で 15 分間 RapiGest を沈殿させ、サンプルを 1800 × g で 10℃ で 15 分間遠心分離して、 RapiGest をペレット化しました。各サンプルを 30 µL ずつ QuanRecovery 96 ウェルプレートに移し、LC-MS/MS 分析のために、Xevo TQ-S micro 質量分析計に接続した ACQUITY UPLC I-Class PLUS システムに 5 µL を注入しました。
|
LC システム: |
ACQUITY UPLC I-Class PLUS(固定ループ) |
|
MS システム: |
Xevo G2-XS QTof 質量分析計、ESI+ |
|
サンプルプレート: |
MaxPeak High Performance Surfaces(HPS)を採用した QuanRecovery バイアル |
|
カラム: |
ACQUITY UPLC PREMIER Peptide BEH C18、300 Å、1.7 μm、2.1 × 100 mm |
|
カラム温度: |
60 ℃ |
|
サンプル温度: |
10 ℃ |
|
注入量: |
10 μL |
|
流速: |
0.2 mL/分 |
|
移動相 A: |
0.1% ギ酸水溶液 |
|
移動相 B: |
0.1% ギ酸アセトニトリル溶液 |
|
グラジエント: |
50 分で 1 ~ 35% B(0.2 mL/分)、続いてカラム洗浄および平衡化 |
|
イオン化モード: |
ESI+ |
|
キャピラリー電圧: |
1.2 kV |
|
コーン電圧: |
40 V |
|
ソース温度: |
150 ℃ |
|
脱溶媒温度: |
350 ℃ |
|
コーンガス流量: |
20 L/時間 |
|
脱溶媒ガス流量: |
600 L/時間 |
|
データ収集およびデータ解析インフォマティクスシステム |
UNIFI(v.1.9.4) |
|
LC システム: |
ACQUITY UPLC I-Class PLUS(固定ループ) |
|
MS システム: |
Waters Xevo TQ-S micro 質量分析計、ESI+ |
|
サンプルプレート: |
MaxPeak High Performance Surfaces を採用した QuanRecovery 96 ウェルプレート |
|
カラム: |
ACQUITY UPLC PREMIER Peptide BEH C18、300 Å、1.7 μm、2.1 × 100 mm |
|
カラム温度: |
60 ℃ |
|
サンプル温度: |
10 ℃ |
|
注入量: |
5 µL |
|
流速: |
0.4 mL/分 |
|
移動相 A: |
0.1% ギ酸水溶液 |
|
移動相 B: |
0.1% ギ酸アセトニトリル溶液 |
|
グラジエント: |
1 分間で 10 ~ 15% B、3 分間で 15 ~ 30% B。続いてカラム洗浄と平衡化。分析時間 7 分。 |
|
イオン化モード: |
ESI+ |
|
キャピラリー電圧: |
1.2 kV |
|
コーン電圧: |
20 V |
|
ソース温度: |
150 ℃ |
|
脱溶媒温度: |
600 ℃ |
|
コーンガス流量: |
100 L/時間 |
|
脱溶媒ガス流量: |
1000 L/時間 |
|
MS データ収集: |
MassLynx v4.2 |
|
データ解析用インフォマティクス: |
TargetLynx XS v4.2 |
ペプチドマッピングアプローチを用いた HPV L1 タンパク質の特性解析は、定量のためのペプチド候補の選択に役立ち、脱アミド化や酸化などのタンパク質骨格の修飾の存在が確認できることもあります。タンパク質の分析および定量の完全なワークフローについては、Fc を含むタンパク質についてのアプリケーションノート 720006969EN で既に説明しており、これに若干の変更を加えてここで使用しています3。ガーダシル 9 に存在する 9 種の HPV L1 タンパク質すべてについて、ペプチドマッピング実験を行いました。例として図 1 に示すように、優れたフラグメンテーションデータによって HPV 18 のペプチド FSLDLDQYPLGR が確認されています。このペプチドを HPV 18 のサロゲートとして選択した理由として、強度、修飾の可能性が低いこと、定量的な再現性があることが挙げられます。各サロゲートペプチドの MRM トランジションを同定し、MassLynx-Skyline インターフェースワークフローにより最適化しました4。
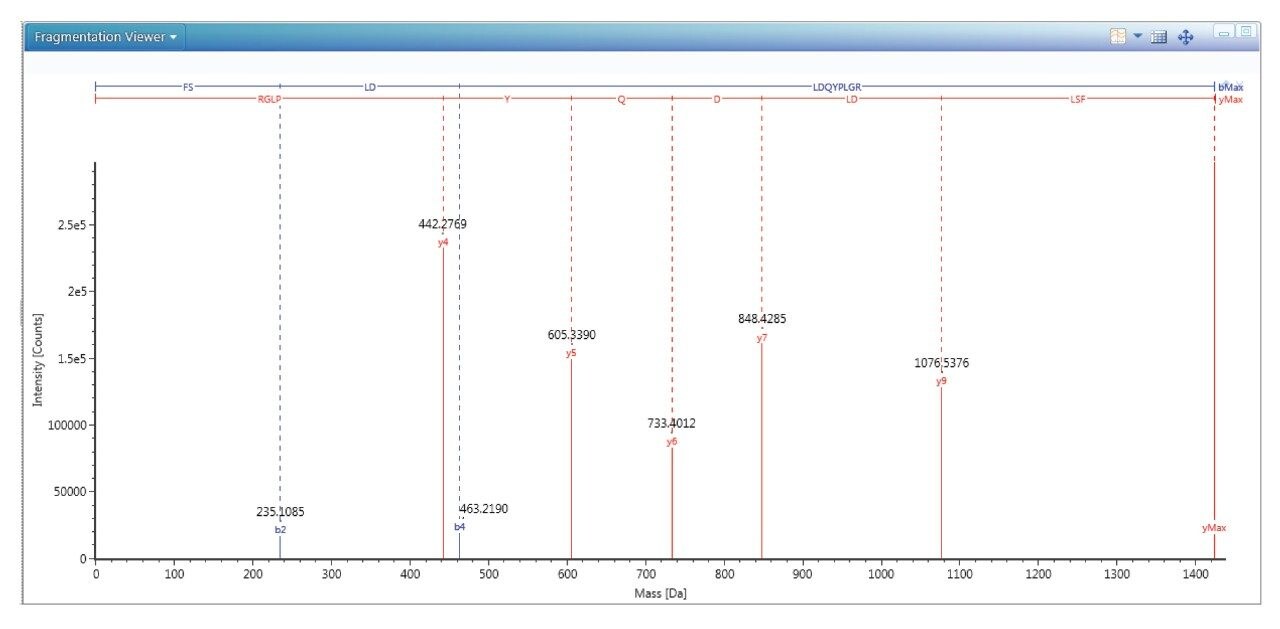
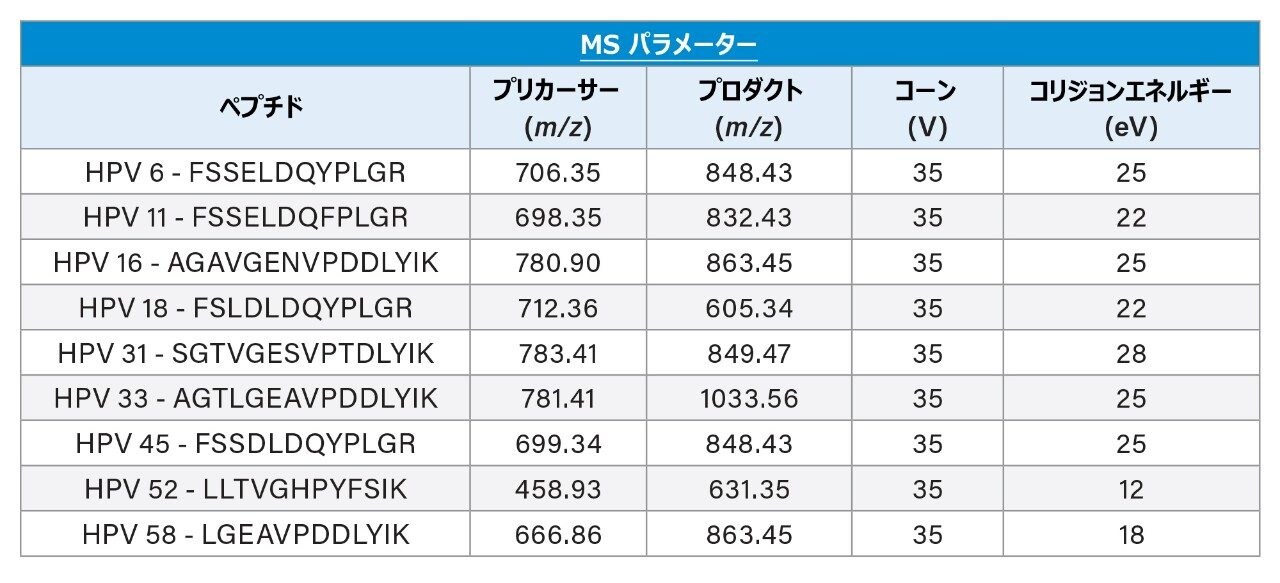
ペプチドマッピング実験によってサロゲートペプチドが同定された後、最適化したクロマトグラフィー法を用いて各ペプチドのプリカーサーイオン質量をモニターすることにより、これらのペプチドの保持時間を特定します。各ペプチドプリカーサーについて最も強度が強いチャージ状態を選択し、選択したペプチドのすべての b および y イオンのプロダクトイオンを包括的に調べて、最も強い MRM トランジションを特定します。この一番強い MRM トランジションを、コリジョンエネルギーについてさらに最適化し、これらの最適なパラメーターを含む最終的な MS メソッドを作成します。定量に用いた MRM トランジションを表 1 に示します。
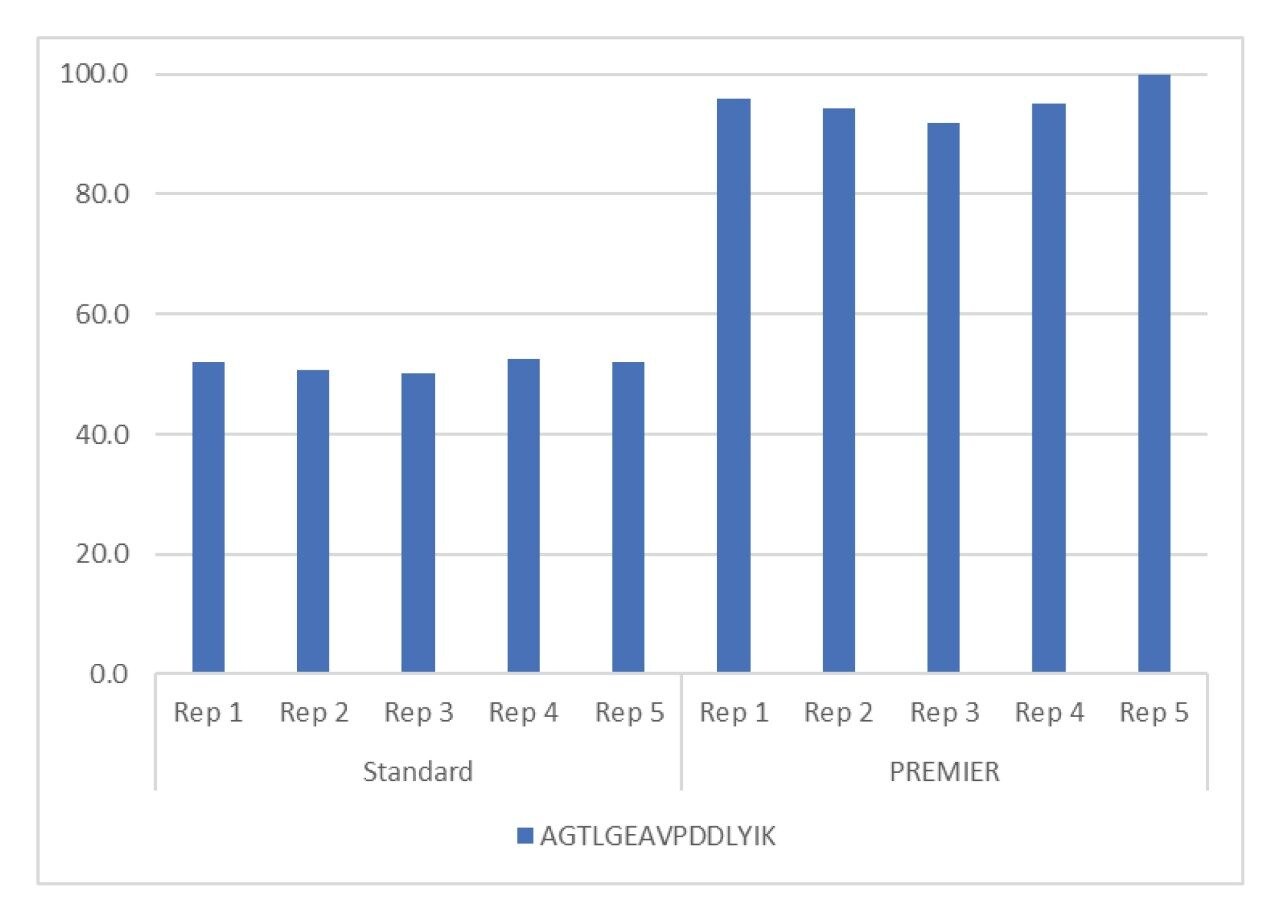
カラムの選択は、LC 分析法開発プロセスの重要な部分です。HPS(High Performance Surfaces)テクノロジーを採用した ACQUITY PREMIER Peptide BEH C18 300Å カラムは、HPV L1 タンパク質の定量に最適であることが分かりました。図 2 に、標準的なカラムと PREMIER カラムの比較を示しています5。両方のカラムに不動態化用の高濃度サンプルを 10 回注入して不動態化し、続いて分析種を 5 回注入しました。MaxPeak HPS テクノロジーを採用した PREMIER カラムにより、より迅速なカラムの不動態化処理が可能になり、標準カラムに比べてピーク面積が 2 倍に増加しました。このピーク面積の増加により、定量限界が低くなり、ペプチド測定の再現性が向上しています。
アジュバントの効率的な除去は、アジュバント添加ワクチン製品における抗原濃度の定量的測定を成功させる鍵となります。タンパク質は、静電気力、疎水性相互作用、ファンデルワールス力による水素交換、およびリガンド交換により、アルミニウムアジュバントと結合します6。 リガンド交換は、アジュバント表面の水酸基とタンパク質抗原のリン酸基との相互作用の結果として生じ結果であり、タンパク質を最も強く結合させます。ガーダシル 9 には、表面に水酸基とリン酸基を持つ独自のアモルファスのヒドロキシリン酸アルミニウム(AAHS)がアジュバントとして添加されています7。このワクチンは約 pH 7.0 になるように処方されており、この pH では AAHS が荷電ゼロになる点があります8。抗原の HPV L1 タンパク質 VLP は、等電点が 8.1~8.6 であるため、処方されたワクチン製品では正に荷電しています9,10。
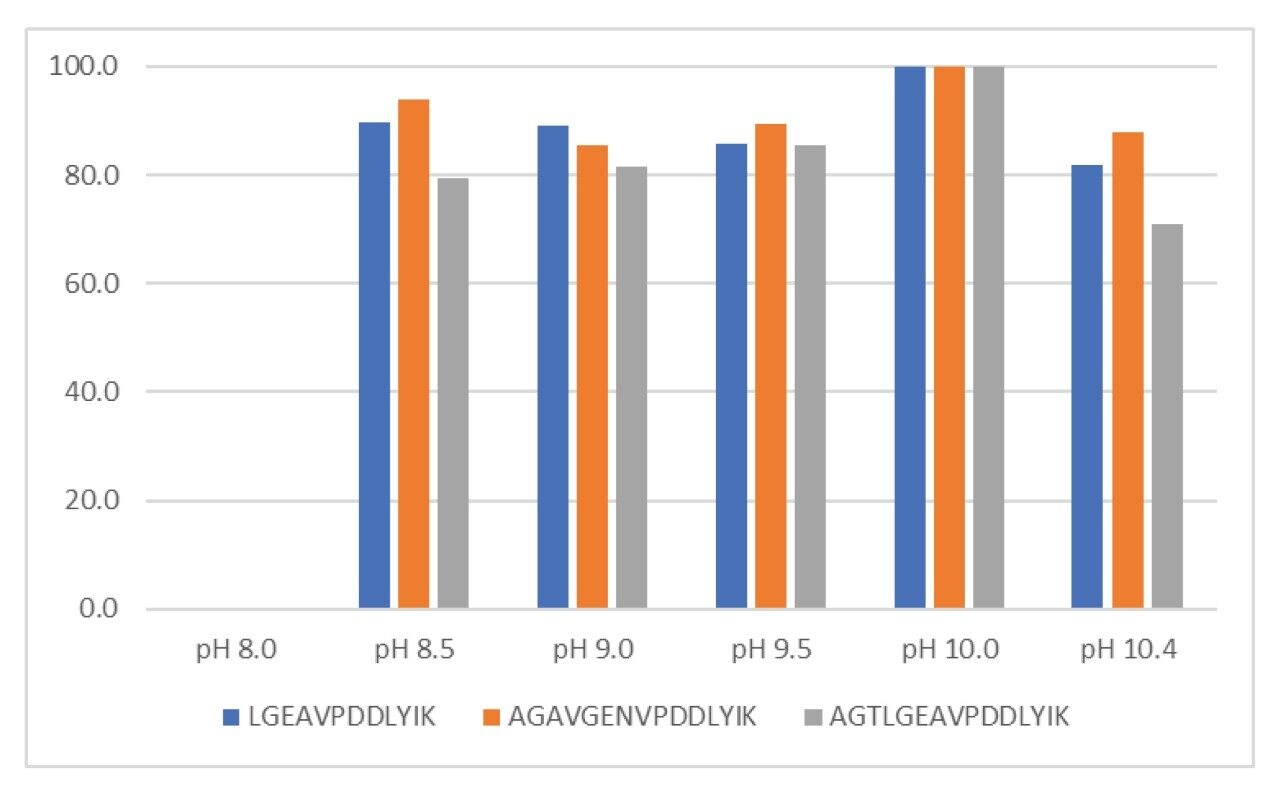
この吸着を阻害して、AAHS アジュバントからタンパク質を完全に脱離し、VLP 自体の解離を始めるには、界面活性剤と高 pH が必要になることが実験で確認されています11。 ここでは、完全に脱離させるのに必要な MS に適した界面活性剤 RapiGest を使用して、HPV L1 タンパク質を変性させました。また、このアジュバント除去プロトコルでは、高 pH を用いて HPV L1 タンパク質の電荷を正から負に完全に切り替えます。図 3 に示すように、pH 10.0 で、アジュバントからのタンパク質脱離が最高レベルになりました。タンパク質が正に荷電すると予想される pH 8.0 では、ほとんどタンパク質脱離が見られなかったことに注意してください。注目すべき重要事項は、タンパク質が正に荷電すると予想される pH 8.0 では、ほとんどタンパク質脱離が見られなかったことです。この結果は、結合を十分に阻害し、タンパク質を脱離させるには、静電反発力が必要であることを示しています。この結果によって、結合を十分に阻害し、タンパク質を脱離させるには、静電反発力が必要であることが分かります。
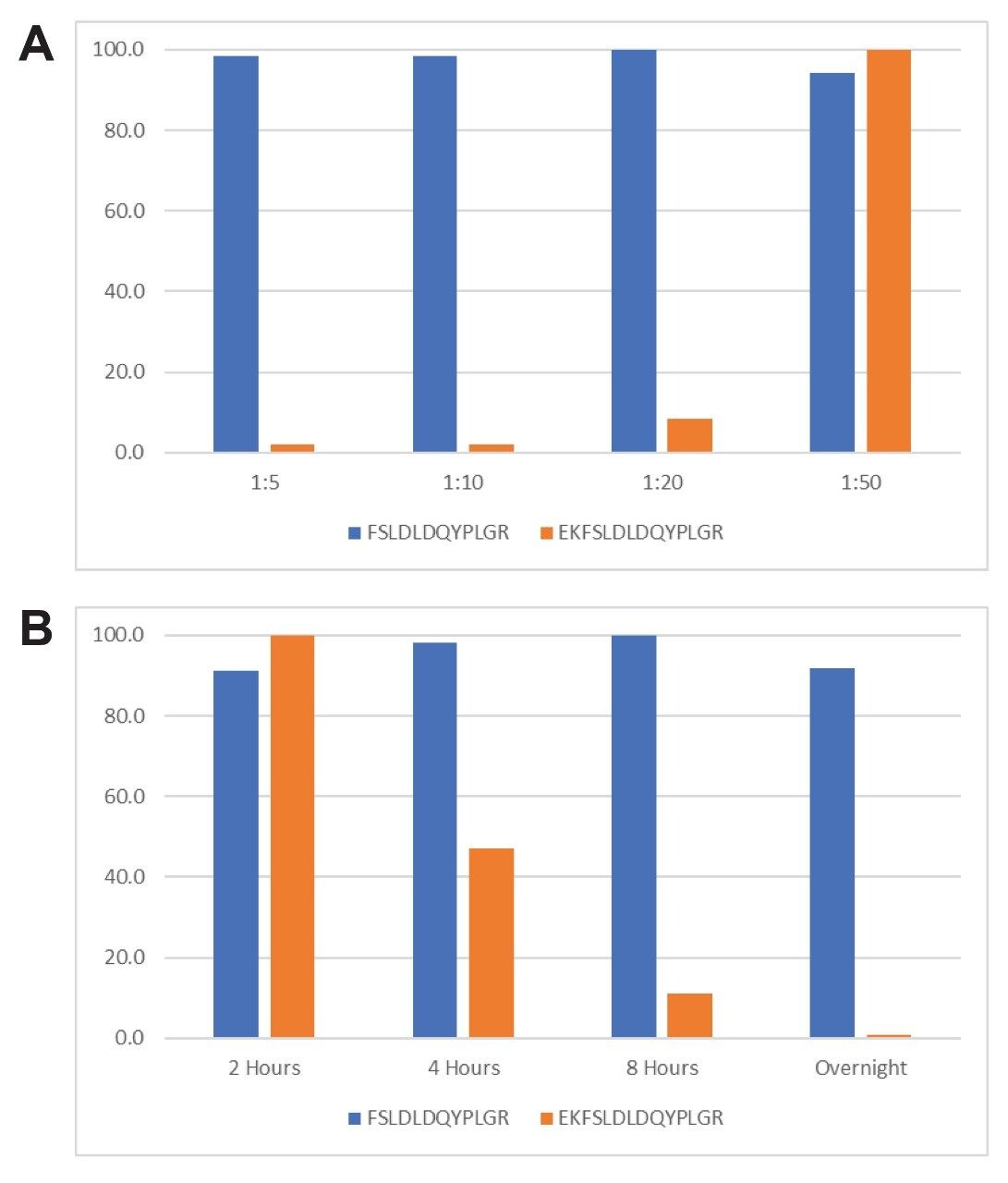
サロゲートペプチドメソッドによる、正確で感度が高く、再現性のある定量には、タンパク質の完全な消化が不可欠です。完全な消化を行う達成するためには、酵素:基質比や消化時間などの消化のパラメーターを検討し、最適化する必要があります。消化の完全性を測定するため、ペプチド FSLDLDQYPLGR およびミスクリーベージ 1 ヶ所をもつペプチド EKFSLDLDQYPLGR をモニターし、定量しました。
様々な酵素:基質比で一晩消化した結果に基づいて、タンパク質とトリプシンの比を最適化しました。これらの実験の結果を図 4 のパネル A に示します。トリプシン:タンパク質比が 1:10 と 1:5 の場合に、ペプチド FSLDLDQYPLGR の強度が最大になり、ペプチド EKFSLDLDQYPLGR の強度が最小になって、HPV L1 タンパク質の消化がより完全に近づいている消化されていることが示唆されました。高濃度のトリプシンが必要なために起こるトリプシンの自己消化を低減するために、残りの実験では 1:10 の比を選択しました。消化時間の評価を図 4 のパネル B に示します。8 時間から一晩かけて消化した場合に、HPV L1 タンパク質の消化が最も完全に近づきました。8 時間から一晩かけて消化した場合に、HPV L1 タンパク質はほとんど完全に消化されていました。消化の完全性と勤務時間の都合から、一晩消化することを選択しました。
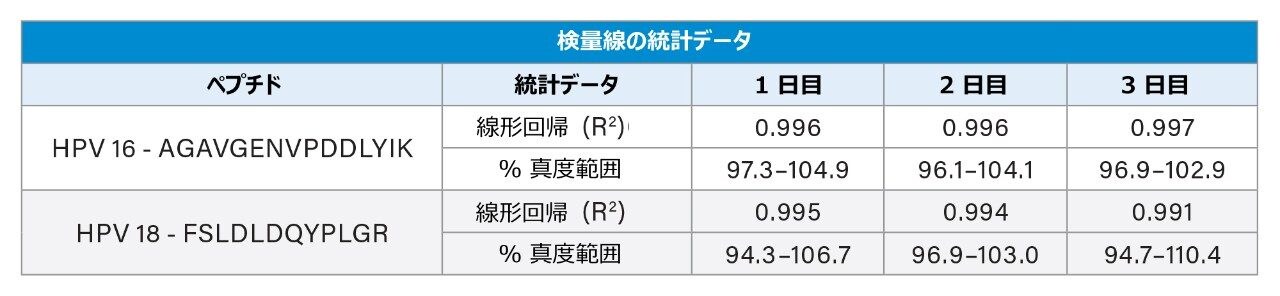
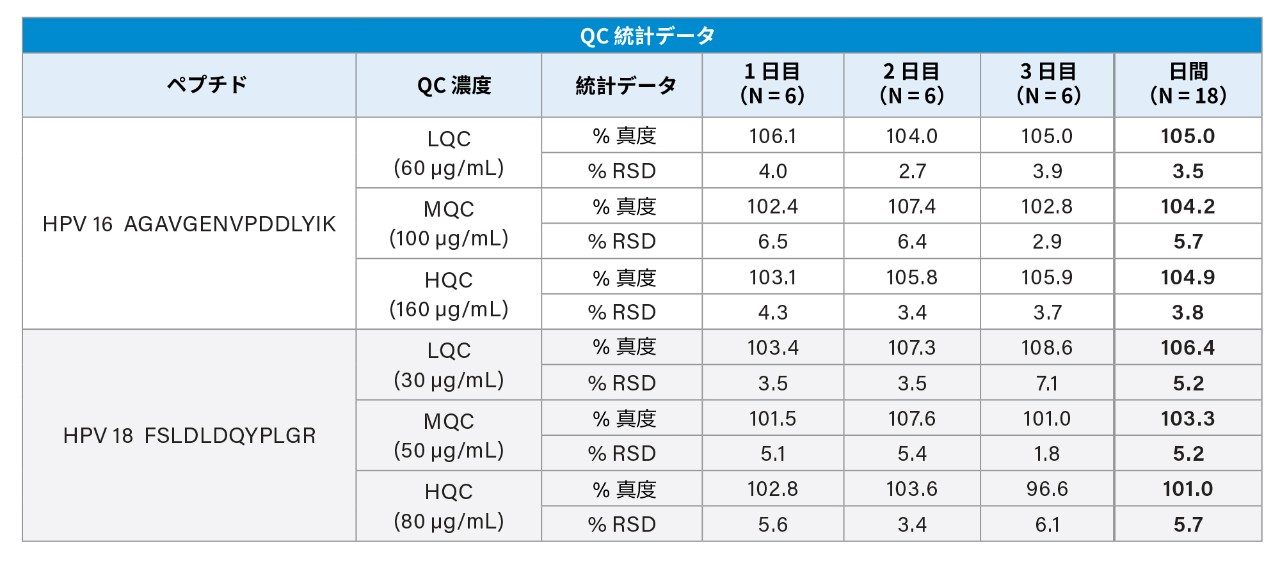
検量線、QC、およびワクチン製剤のサンプルを 3 日にわたってそれぞれ調製し、日間および日内でのアッセイの精度と真度についてバリデーションしました。HPV 16 の検量線は 20 ~ 200 µg/mL の範囲で直線性を示しました。残りの HPV タンパク質は 10 ~ 100 µg/mL の範囲で直線性を示しました(表 2)。低、中、高濃度の QC サンプルを調製したところ、QC の真度および精度の CV は 8% 以内でした(表 3)。表 4 に示すように、9 種の HPV L1 タンパク質すべてについて、3 回の調製および 3 日間の測定にわたる CV が 8% 以内と、再現性が非常に高いことがわかりました。ほとんどの場合、この試験における LC-MS/MS の測定値は一般に表示値と一致しましたが、一部は表示値より高い値でした。これらの結果は、このアッセイがガーダシル 9 中の HPV L1 タンパク質の定量に適していることを示しています。
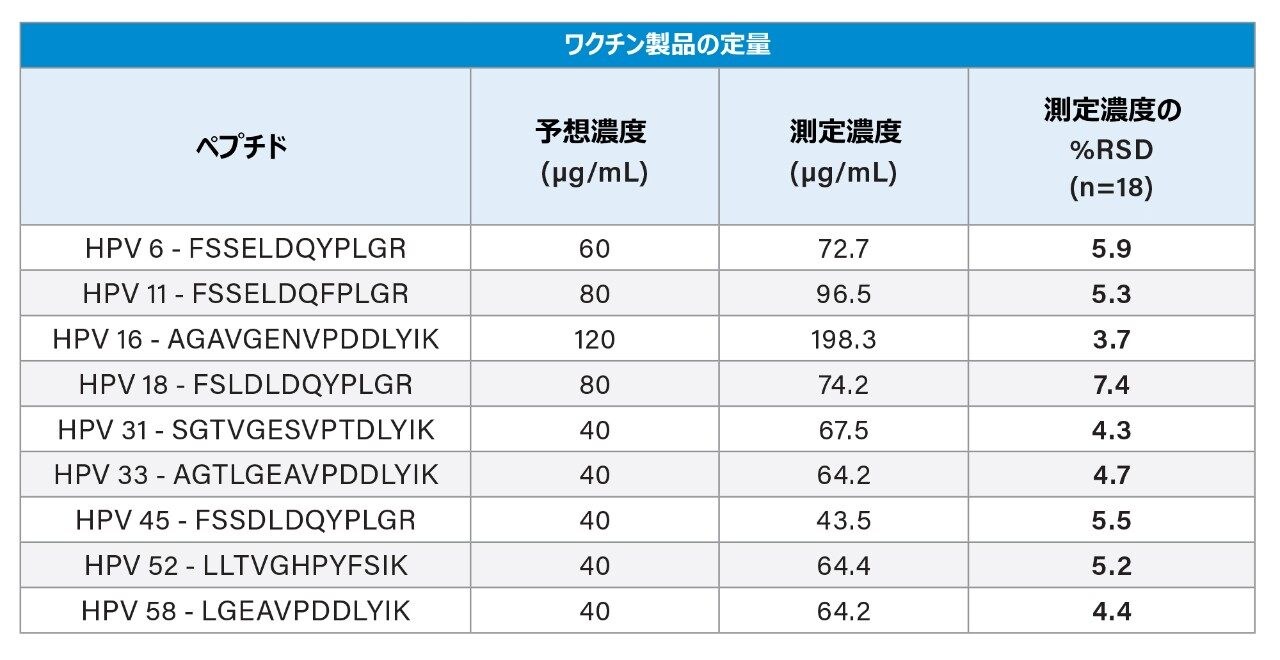
ガーダシル 9 中の HPV L1 タンパク質抗原の同時定量のための質量分析法を開発しました。最適化したサンプル前処理と組み合わせることで、LC-MS/MS によりタンパク質を高い真度と精度で定量できました。
720007103JA、2020 年 12 月