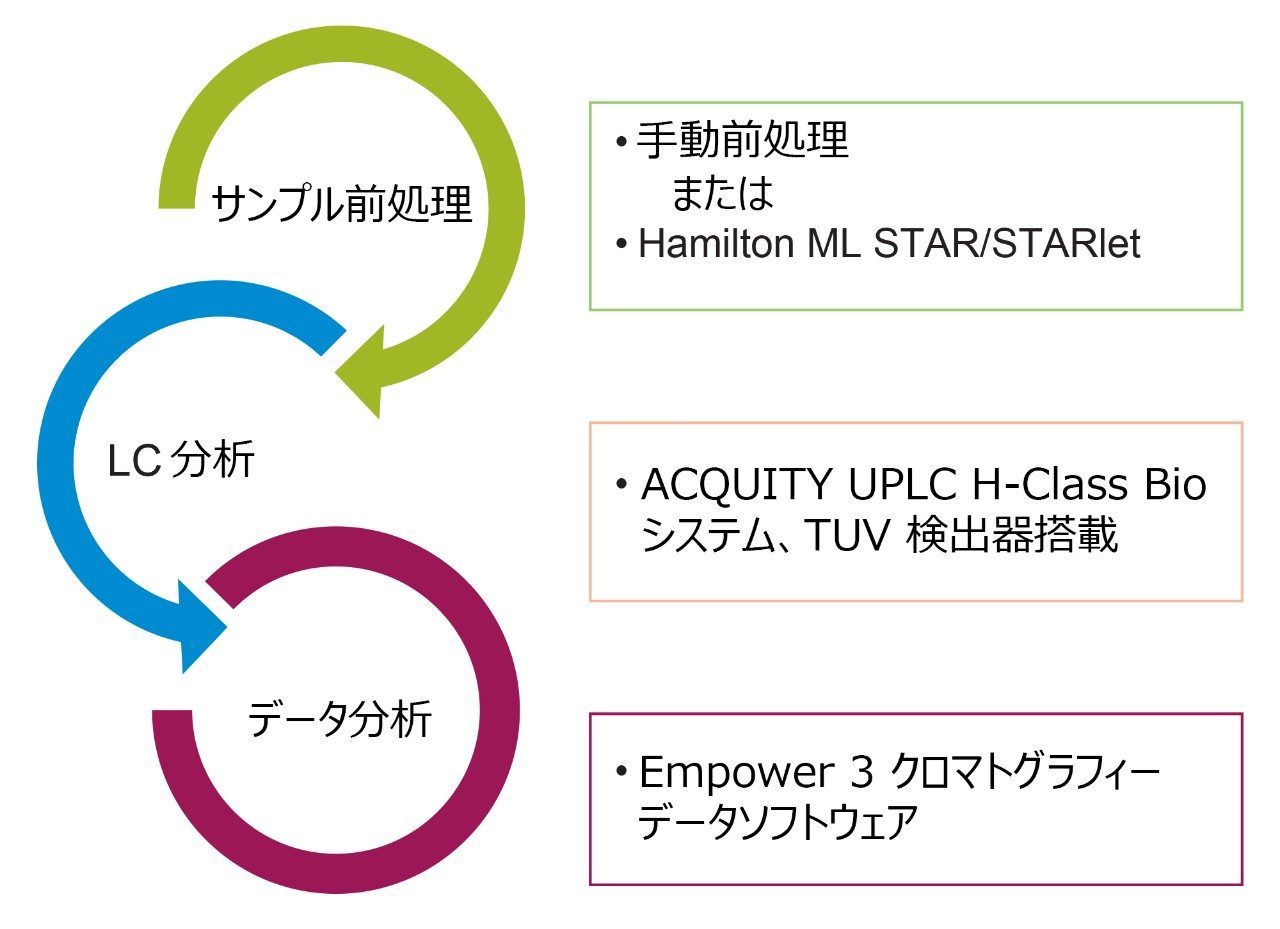
本アプリケーションノートでは、AccQ●Tag 標識アミノ酸の、手動による前処理と、Hamilton Microlab (ML) STAR 自動プラットホーム上でアミノ酸細胞培養標準キットを用いた自動前処理との同等性と堅牢性を実証します。
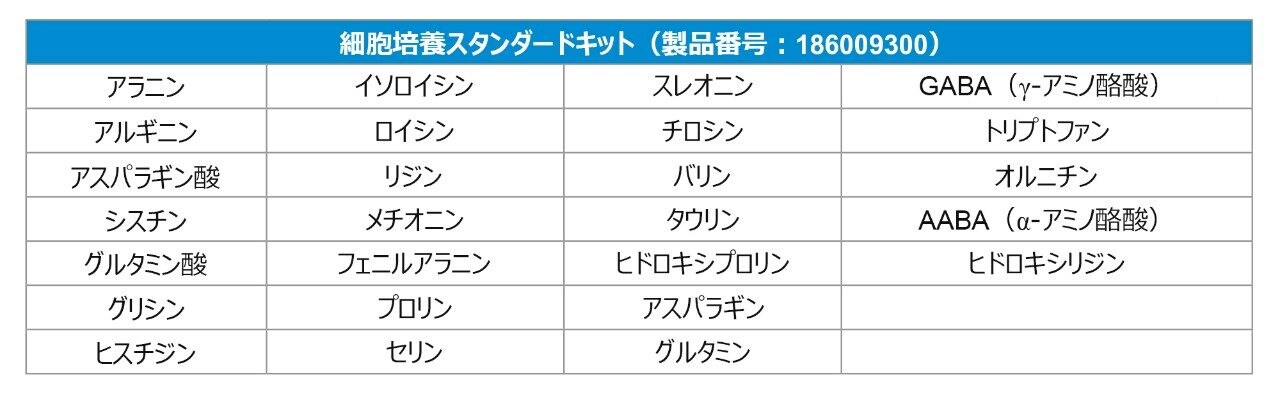
アミノ酸は、タンパク質の一次構成要素であり、それらの配列は各タンパク質やペプチドに固有です。これらは細胞の増殖や修復に欠かせません。アミノ酸組成の決定は、バイオ医薬品の前処理およびタンパク質加水分解物を扱う分野において非常に重要です。細胞培養の培地中では、アミノ酸の濃度は細胞の代謝および輸送の要件によって異なります1。 バイオリアクター培地のアミノ酸成分のモニタリングおよび最適化は、細胞を増殖させる最善の状態を確認するために不可欠です。そのため、アミノ酸分析は製薬業界における必須要件です。Waters アミノ酸細胞培養スタンダードキットには、細胞培養で極めて重要な 9 種の追加のアミノ酸が含まれ、17 アミノ酸の加水分解物標準品を補足するよう設計されています。細胞培養アミノ酸の添加は、それらが細胞増殖に必須の主要指標アミノ酸を含むという点で重要です(表 1)。
アミノ酸の誘導体化はアミノ酸分析の主要なステップです。Waters UPLC アミノ酸ソリューションは、プレカラム AccQ●Tag Ultra 誘導体化キット、ならびに再現性向上のための品質保証カラムと溶離液を備えた最適なシステム設定で構成されています。自動化はサンプル前処理においてますます成長している分野です。自動化プラットホームにより、手動の前処理と比べてばらつきが抑えられ、ラボの生産性が向上します2。 AccQ●Tag Ultra 誘導体化キットは、自動前処理に必要な試薬を増量して提供しています。
本アプリケーションノートでは、AccQ●Tag 標識アミノ酸の、手動による前処理と、Hamilton Microlab (ML) STAR 自動プラットホーム上でアミノ酸細胞培養スタンダードキットを用いた自動前処理との、同等性と堅牢性を実証します
|
システム: |
ACQUITY UPLC H-Class BIO、TUV 検出器搭載 |
|
サンプル温度: |
20 ˚C |
|
分析カラム温度: |
43 ˚C |
|
流速: |
700 µL/分 |
|
サンプル注入量: |
1 µL |
|
カラム: |
AccQ●Tag Ultra、1.7 µm、2.1 × 100 mm |
|
UV 検出: |
260 nm |
|
移動相 A: |
100% AccQ●Tag Ultra 溶離液 A |
|
移動相 B: |
90:10 水、AccQ●Tag Ultra 溶離液 B |
|
移動相 C: |
100% HPLCグレードの水 |
|
移動相 D: |
100% AccQ●Tag Ultra 溶離液 B |
A. スクリプト機能(オプション)
Hamilton 自動化プラットホーム(ML STAR/ML STARlet)用のこのスクリプトは、バーコードエクスポートを用いて、エクスポートされたデータからクロマトグラフィーデータシステム内にサンプルリストを構築することができ、手動でデータを入力する際に起こりやすいミスを最小限にします。Hamilton スクリプトは、標準試料を 500 µM~0.5 µM のレファレンス範囲(シスチン 250~0.25 µM)に希釈する性能をを備え、機能が強化されました。さらに、細胞培養サンプルは、使用可能なワークリストインポート機能を使用してその場で希釈することができます。サンプル数とウェルの開始位置を選択すると、32、64、または 96 サンプルの AccQ●Tag Ultra 自動誘導体化キットを実行できるというメリットがあります。サンプル前処理の際、オプション機能としてノルバリン内部標準試料 (製品番号:186009301)を含めるよう柔軟に選択できます。
B. AccQ●Tag Ultra 自動誘導体化キット(製品番号:186009232)
デッドボリュームの要件が増加したことにつき、AccQ●Tag Ultra 自動誘導体化キットでは、自動化システムでの使用に必要な試薬の量が増加しました。この試薬供給量により、96 のサンプルを 3 × 32 のサンプルフォーマットで前処理することができます。
C. 実験器具
アミノ酸サンプルを AccQ●Tag 誘導体化キットを使用して手動で前処理する場合は、Waters トータルリカバリーバイアルを使用して実施します。これを自動化に対応させるため、これらのガラス製バイアルを 96-ウェルコレクションプレート(製品番号:186002481)に置き換えました。実験器具の変更をサポートするために広範な実行可能性テストが行われ、製品の性能に関して影響は認められませんでした。
D. 実験デザイン
最低 3 ロットの溶離液、カラムおよび AccQ●Tag Ultra 誘導化自動化キットを、分析法の頑健性を実証するための試験で評価しました。その詳細は頑健性のセクションでご覧いただけます。異なる分析者(n = 4)の評価も試験を通して行い、自動化ワークフローがユーザーに依存しないことを実証しました。
Hamilton 自動化プラットホームを使用した自動前処理を評価し、頑健性と同等性について既存の手動前処理と比較しました。3 回の前処理にわたり、各前処理ごとに 3 連の繰り返し注入を 3 つの濃度(10 µM、200 µM、400 µM)で行い、性能の特徴をモニターすることにより、実験結果の正確度と精度(保持時間、分析種のピーク面積、濃度)ならびに直線性を判定しました。内部標準試料(ノルバリン)を全実験で使用しました。ノルバリン内部標準試料の使用により、サンプルの加水分解やアミノ酸分析中に生じるばらつきが最も良く補正できます。
図 3 は、カラムでの 10 pmol の細胞培養スタンダードの代表的なクロマトグラムを示しています。
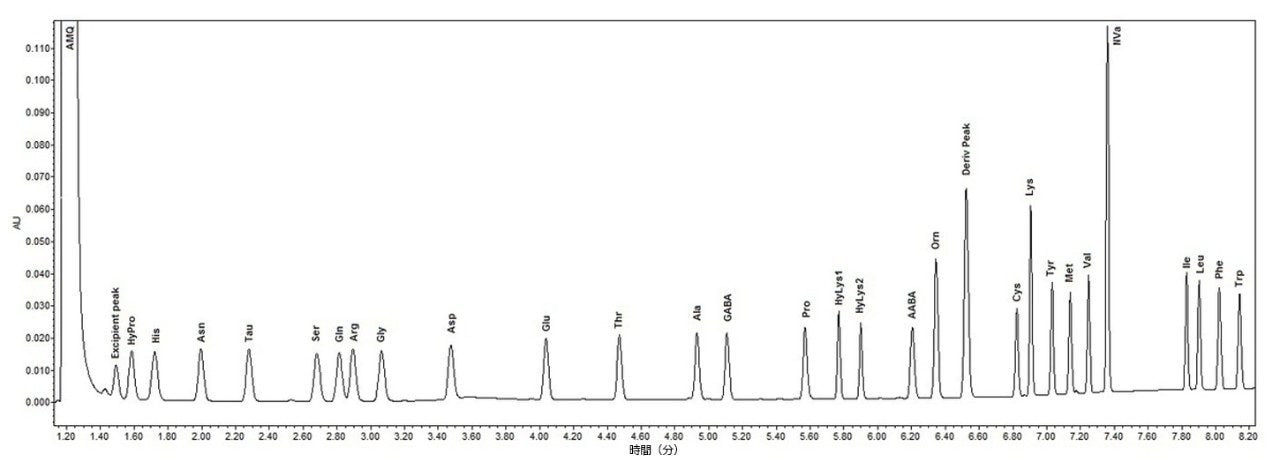
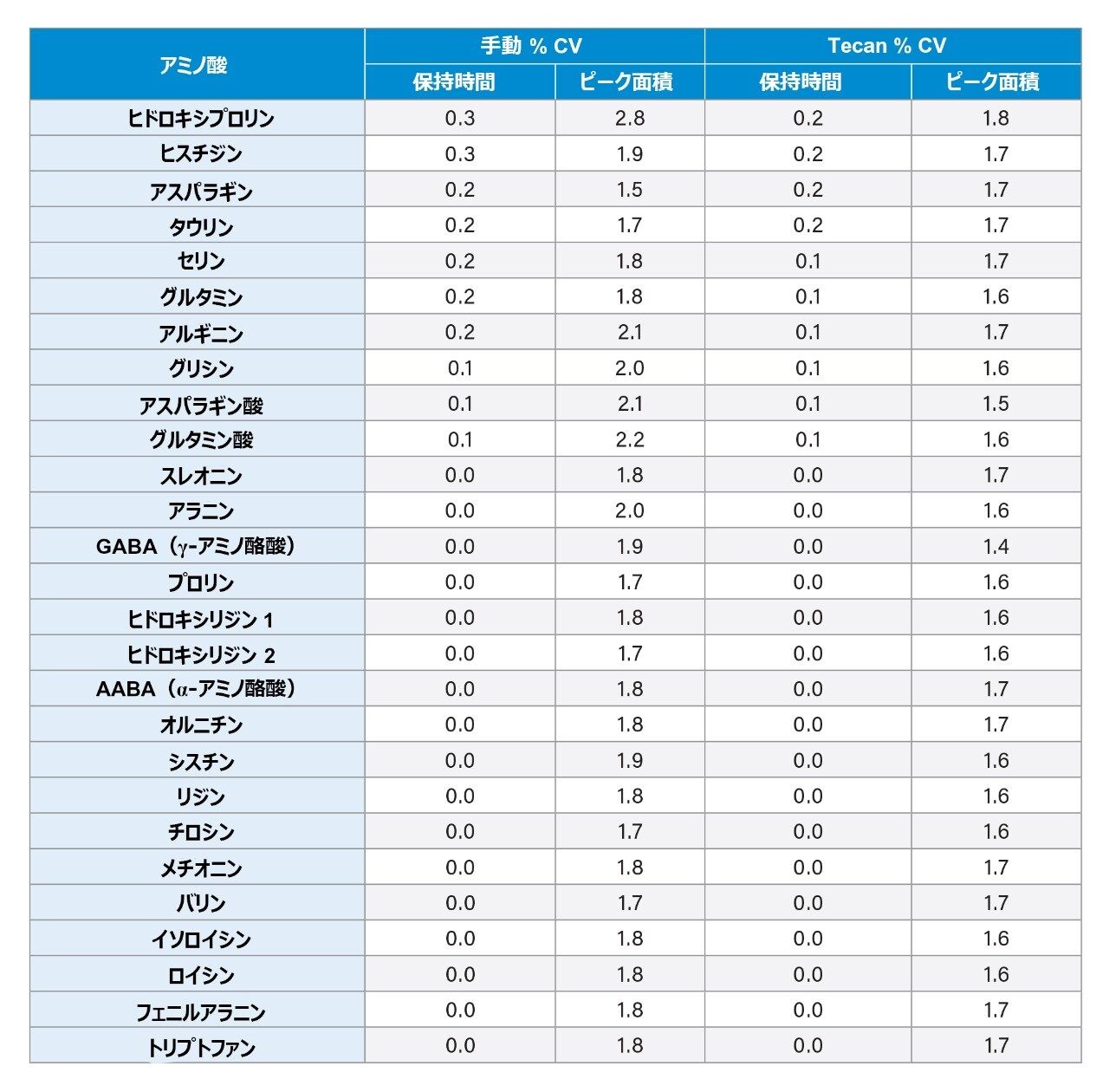
液体クロマトグラフィーでは、クロマトグラフィーのピークを特定する基本的な規準は保持時間です。表 2 に示すように、保持時間の %CV は 0.3% 以下であり、すべての分析法にわたって同等であることがわかります。注入および前処理にわたって分析物のピーク面積が一定であるということは、サンプル前処理および分析法の両方で再現性があるということです。このデータは、自動の AccQ●Tag 前処理法の再現性が優れていることを実証しており、全ての分析種にわたる最大 %CV が、手動の前処理では 2.8% 以下、Hamilton の前処理では 1.1% 以下であることを示しています。
10、200、400 µM の各濃度ごとに 3 回の前処理、各前処理ごとに 3 回の繰り返し注入で正確度を評価しました。10 µM のパネルでは、Hamilton 自動化法を使用して前処理した各アミノ酸の回収率(%)は、目標濃度の±20% の範囲内でした。200 および 400 µmのパネルでは、Hamilton 自動化法を使用して前処理した各アミノ酸の回収率(%)は、目標濃度の±15%の範囲内でした。この回収率データおよび表 3 に示した精度データは、Hamilton 自動前処理プラットホームが、アミノ酸の手動誘導体化の、時間を節約できる代替法として適格であることを実証しています。
また、独立した評価手段としての回収率を NIST SRM 細胞培養スタンダード 2389a と比較して分析しました。Hamilton 自動前処理プラットホームを使用して細胞培養スタンダードから 200 µM のパネルを調製し、単一の NIST スタンダード(250 µM [SRM の 10 分の 1] の濃度で調製)を使用して既存の手動方法における回収率を計算し、同時に UPLC 分析を行いました。Hamilton 自動前処理では、回収率は 91%(リジン)から 104%(アスパラギン酸)までの範囲でした。このことにより、アミノ酸細胞培養スタンダードの正確度を SRM との比較で実証しています。
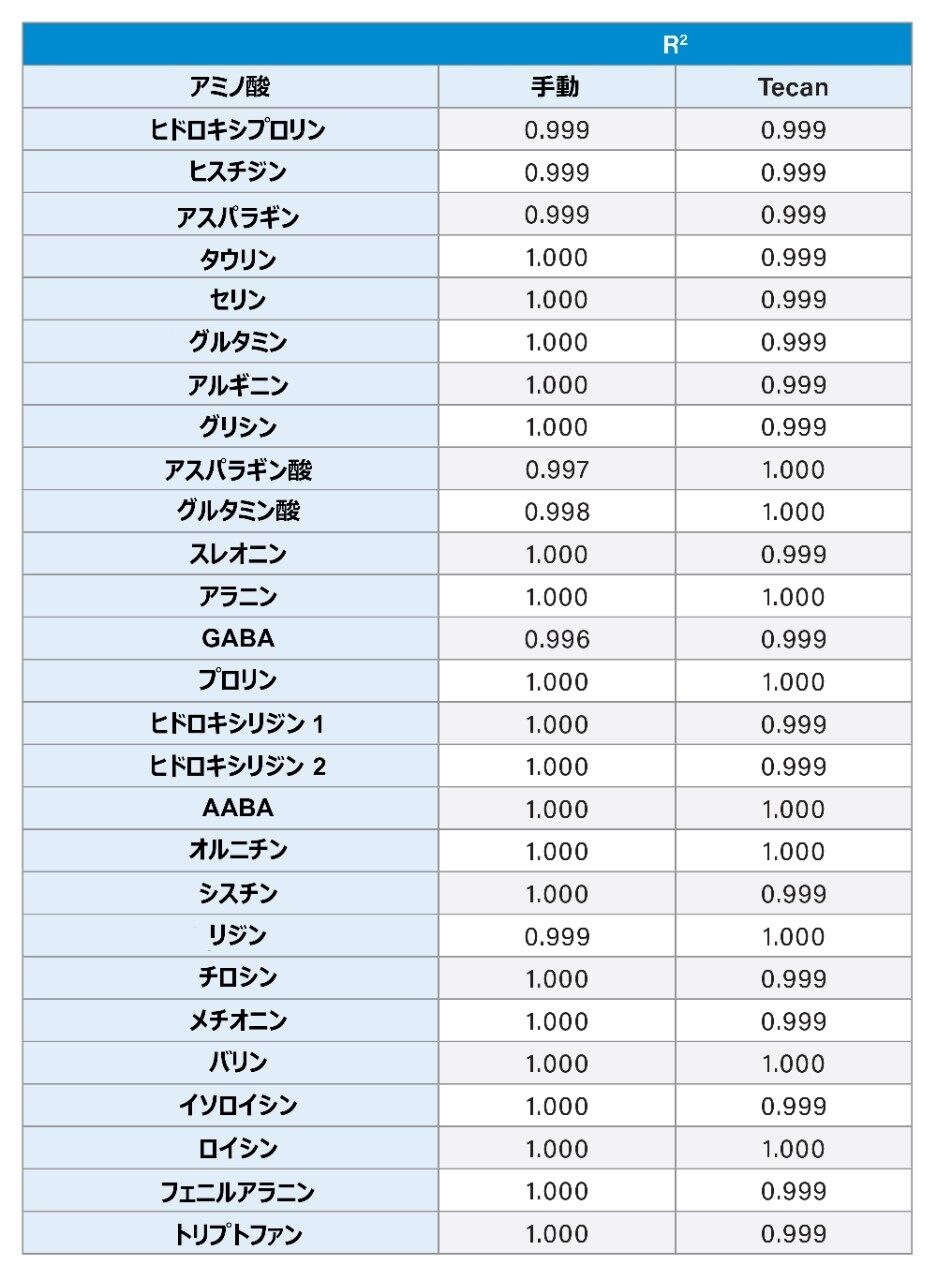
直線性は、各アミノ酸について、0.5–500 µM(シスチン 0.25~250 µM)の範囲にわたる 7 つの濃度に調製した細胞培養スタンダードを使用して評価しました。すべての分析を直線性について評価し、すべて r2 が 0.995 未満という基準を満たしており、キャリブレーション試薬 2–7 (2.5-500 µM) の予想濃度から 15%、およびキャリブレーション試薬 1(0.5 µM)の予想濃度から 20% をそれぞれ超えて逸脱した点はありませんでした。手動と自動前処理法のデータには差がなく、傾向も観測されませんでした。
性能の特性である精度、正確度、直線性について、Hamilton の自動前処理と手動前処理が同等であるかどうかを判定しました。結果によると、UPLC アミノ酸分析ソリューション用の 2 つのサンプル前処理法の間で全体的に一致していましたが、比較分析を実施したところ、自動前処理には考慮すべき大きなメリットがあります。
AccQ●Tag Ultra 自動誘導体化キットを使用したアミノ酸の自動分析は、時間とリソースに限りあるラボにとって、現行の手動前処理法の代替となる有望な方法です。得られた結果は、精度、正確度、直線性において差がないことを示しています。
720006953JA、2020 年 7 月