
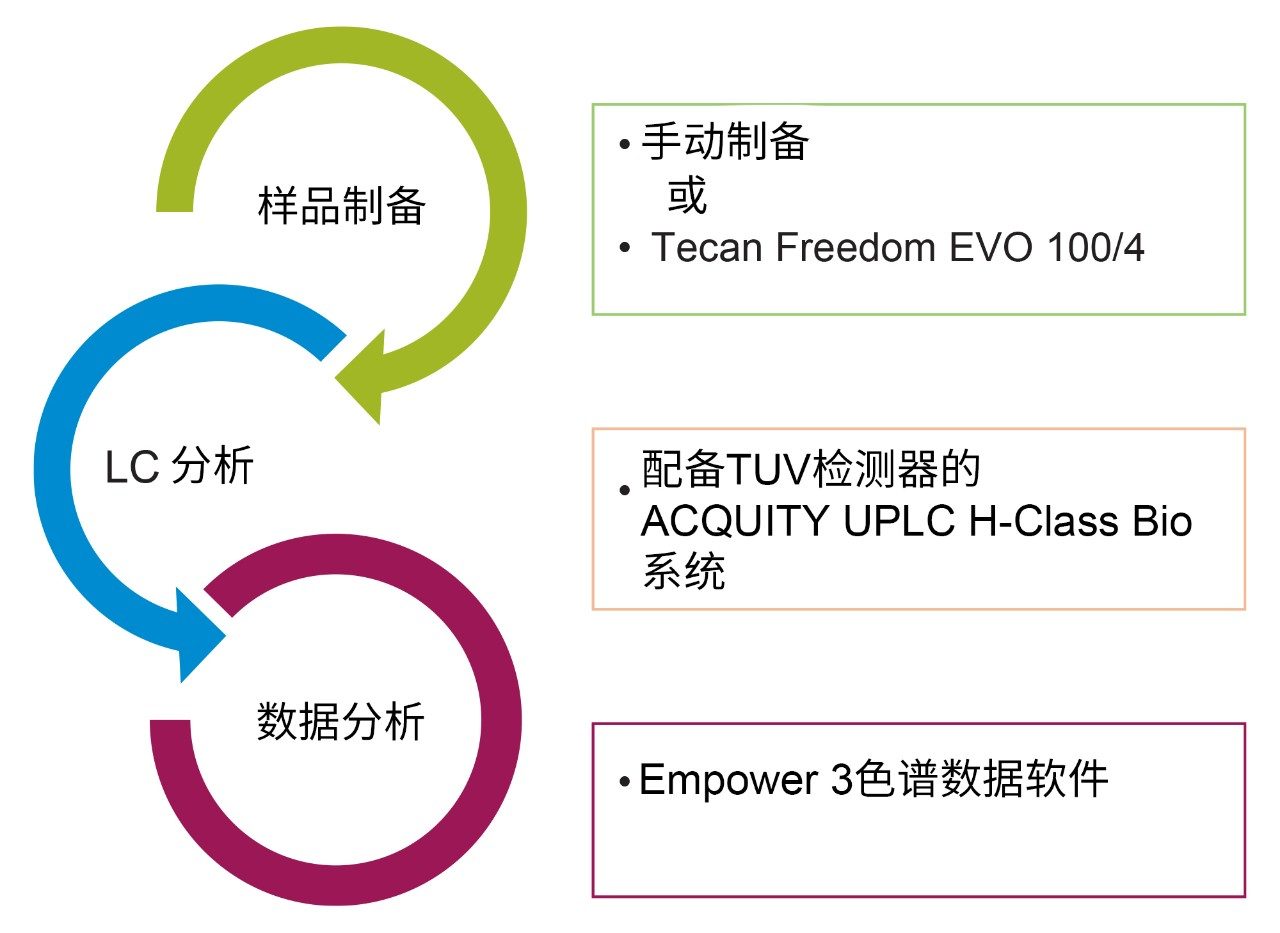
本应用纪要的目的是介绍手动制备AccQ•Tag标记的氨基酸与使用Tecan Freedom EVO 100/4自动化平台以氨基酸细胞培养标准品试剂盒进行制备的方法相比,二者之间的等效性。
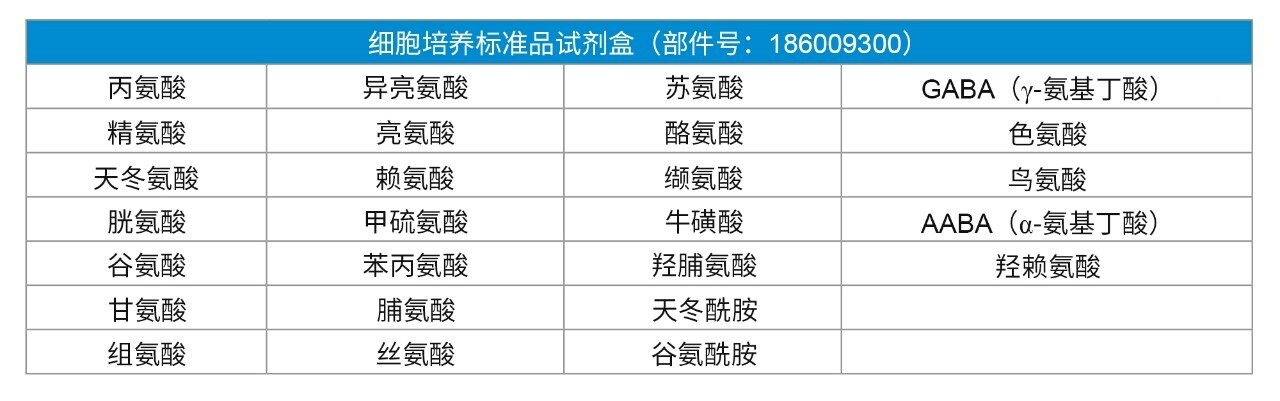
氨基酸是蛋白质的主要组成部分,每种蛋白质或肽所含的氨基酸序列各不相同。细胞的生长和修复过程离不开氨基酸的参与。测定氨基酸组成对于研究生物制剂和蛋白质水解物的领域具有重要意义。在细胞培养基中,氨基酸的浓度取决于细胞的代谢和转运要求。要确保为细胞提供优质生长条件,必须即时监测并优化生物反应器培养基的氨基酸成分1。 因此,氨基酸分析成为制药行业的必要内容。沃特世氨基酸细胞培养标准品试剂盒中额外包含9种对细胞培养至关重要的氨基酸,用于补充17种氨基酸水解物标准品。添加细胞培养氨基酸非常重要,因为其中包含对细胞生长至关重要的关键指标(表1)。
氨基酸衍生化是氨基酸分析中的关键一步。Waters UPLC氨基酸解决方案由柱前AccQTag Ultra衍生化试剂盒,以及配置有认证色谱柱和洗脱液的全面系统组成,旨在提高重现性。自动化在样品制备领域的关注度不断增加,与手动方式相比,自动化平台有助于减少差异性,并可提高实验室效率2。 沃特世提供的兼容型自动化AccQ•Tag Ultra衍生化试剂盒随附的试剂量能够满足自动化样品制备的需求。
本应用纪要介绍手动制备AccQ•Tag标记的氨基酸与使用Tecan Freedom EVO 100/4自动化平台以氨基酸细胞培养标准品试剂盒进行制备的方法相比,二者之间的等效性。
|
系统: |
配备TUV检测器的ACQUITY UPLC H-Class Bio系统 |
|
样品温度: |
20 ˚C |
|
分析柱柱温: |
43 ˚C |
|
流速: |
700 µL/min |
|
进样体积: |
1 µL |
|
色谱柱: |
AccQ•Tag Ultra, 1.7 µm, 2.1×100 mm |
|
UV检测波长: |
260 nm |
|
流动相A: |
100% AccQ•Tag Ultra洗脱液A |
|
流动相B: |
90:10水,AccQ•Tag Ultra洗脱液B |
|
流动相C: |
100% HPLC级水 |
|
流动相D: |
100% AccQ•Tag Ultra洗脱液B |
A. 选配脚本功能
Tecan Freedom EVO 100/4的脚本由条形码导出功能创建,该功能使用户可以在色谱数据系统中根据导出的数据创建样品列表,从而大幅减少手动输入数据时发生的常见错误。增强Tecan脚本的功能,使其能够在500–0.5 µM(胱氨酸250–0.25 µM)的参比范围内执行标准品稀释。此外,使用提供的工作列表导入功能在工作台上稀释细胞培养样品。样品编号和孔板起始位置选择功能让用户能够使用AccQ•Tag Ultra衍生化自动化试剂盒运行32、64或96个样品。制备样品时,还可以灵活加入正缬氨酸内标(部件号:186009301)作为可选功能。
B. AccQ•Tag Ultra衍生化自动化试剂盒(部件号:186009232)
由于自动化系统对死体积的要求更高,AccQ•Tag Ultra衍生化自动化试剂盒增加了试剂量,以便用于自动化系统。随附的试剂量可用于制备96个样品,采用3×32个样品的形式。
C. 实验器皿
以AccQ•Tag衍生化试剂盒手动制备氨基酸样品使用的是沃特世全回收样品瓶。为兼容自动化方案,将这些玻璃样品瓶替换为96孔收集板(部件号:186002481)。针对实验器皿更改执行多种可行性测试以证明更改可行,结果表明更改实验器皿对产品性能无影响。
D. 实验设计
在测试过程中,为证明分析方法的稳定性,至少评估了三批洗脱液、色谱柱和AccQ•Tag Ultra衍生化自动化试剂盒。详细结果参见有关稳定性的部分。在整个研究过程中,还对不同的分析人员(n=4)进行评估,以证明自动化工作流程与用户无关。
本研究评估了使用Tecan Freedom EVO 100/4的自动化制备方法,并将该方法与现有的手动制备方法进行比较,以研究稳定性和等效性。在三种浓度水平(10 µM、200 µM和400 µM)下,对三种制剂,每种制剂重复进样三次进行性能特征监测,确定结果的准确度和精度(保留时间、分析物峰面积和浓度)以及线性。所有实验均使用了内标-正缬氨酸。使用正缬氨酸作为内标可以有效补偿样品水解和氨基酸分析产生的差异性。
图3显示了柱上进样量为10 pmol的细胞培养标准品的代表性色谱图。
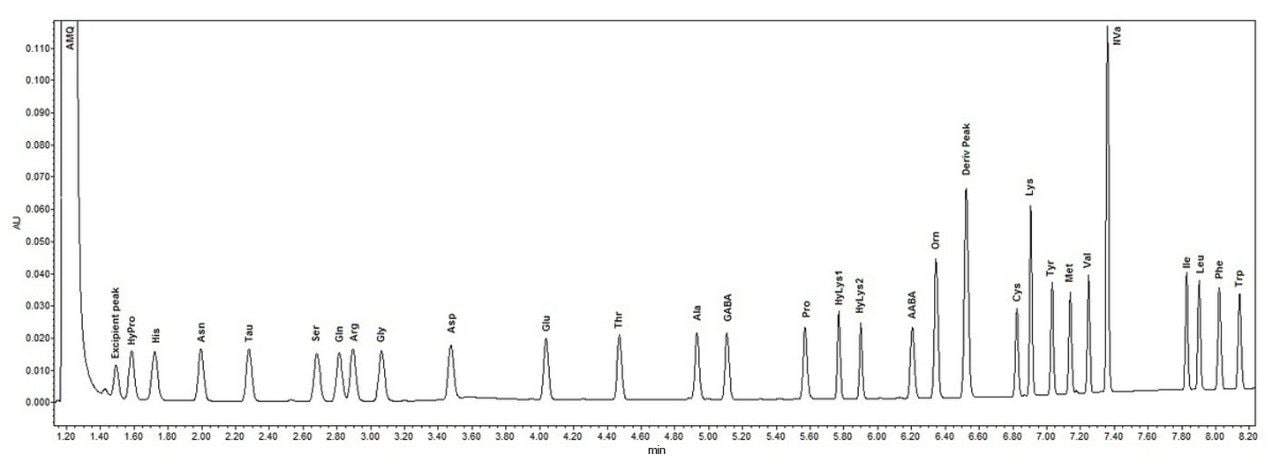
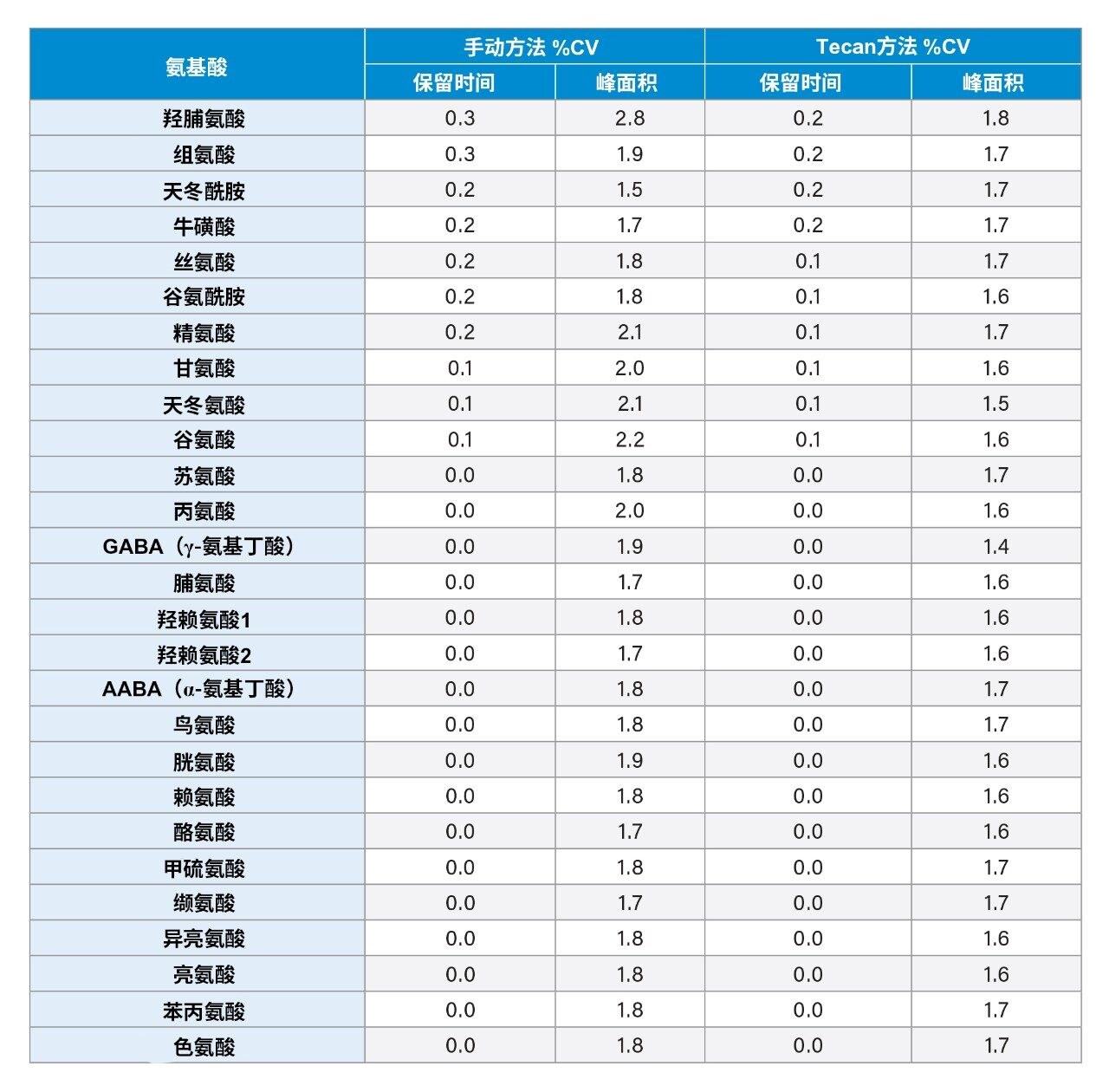
在液相色谱中,保留时间是鉴定色谱峰的主要方法。如表2所示,保留时间的%CV≤0.3%,表明两种方法具有良好的等效性。不同进样和制备方法之间一致的分析物峰面积充分说明,两种样品制备和分析方法具有优异的重现性。表2的数据证明自动化AccQ•Tag制备方法具有优异的重现性,手动制备方法和Tecan制备方法得到的所有分析物的最大%CV分别≤2.8%和≤1.8%。
使用各浓度(10、200和400 µM)下的三种制剂,每种制剂重复进样三次以评估准确度。对于10 µM样品组,使用Tecan自动化方法制备的每种氨基酸的回收率%均在目标浓度±20%的范围内。*对于200 µM和400 µM样品组,使用Tecan自动化方法制备的每种氨基酸的回收率%均在目标浓度±15%的范围内。*该回收率数据以及表3中的精度数据均表明,Tecan自动化制备平台可以用作手动衍生氨基酸的替代方法,并且相当省时。
还分析了细胞培养标准品相比于NIST SRM 2389a的回收率以作为一种独立评估手段。使用Tecan自动化制备方法由细胞培养标准品制备200 µM样品组,并使用通过现有手动方法制得的单一NIST标准品(制成浓度为250 µM[将SRM稀释10倍])计算回收率,两者采用相同的UPLC条件进行分析。Tecan自动化制备方法得到的回收率%在94%(赖氨酸)至110%(天冬氨酸)的范围内。结果表明沃特世氨基酸细胞培养标准品与SRM相比具有出色的准确度。
*丝氨酸是10 µM样品组中的一个异常值,超出针对10 µM样品组设定的±20%的规范。3 µM的差异可能是由于制备过程中的少量污染所致。天冬氨酸是200 µM样品组中的一个异常值,其不符合±15%的规范,但在目标值的20%以内。其它所有分析物均符合规范。
使用细胞培养标准品为每种氨基酸制备七个浓度水平,浓度范围0.5–500 µM(胱氨酸0.25–250 µM),用于评估线性。对所有分析的线性进行评估,结果均符合r2>0.995的标准,且校准品2-7(2.5-500 µM)的浓度点与预期浓度的偏差不超过15%,校准品1(0.5 µM)的偏差不超过20%。利用手动制备方法和自动制备方法获得的数据一致,未观察到任何趋势。

利用精度、准确度和线性等性能特征确定Tecan自动化制备与手动制备方法的等效性。结果表明,两种样品制备方法在UPLC氨基酸分析解决方案中呈现出良好的总体一致性,但在进行对比分析时,自动化方法的显著优势也不容忽视:
对于时间、资源有限的实验室而言,使用AccQ•Tag Ultra衍生化自动化试剂盒对氨基酸进行自动分析,有望替代其现有的手动制备方法。所生成的结果在精度、准确度和线性方面表现出良好的一致性。
720006954ZH,2020年7月