聚山梨醇酯80:探究其对IgG稳定性的影响

随着药品安全法规的不断加强,制造商必须确保其制剂(如聚山梨酯80)不含可见颗粒,且10微米以上的亚可见颗粒数量受限(依据FDA要求)。这些颗粒物不仅源于工艺不稳定性,也与制剂辅料的降解有关。
制造过程中的机械应力可能导致蛋白质聚集,从而影响产品质量和安全性。这种聚集通常源于部分或完全展开的蛋白质暴露的疏水区之间产生的弱相互作用。多种条件(如pH值变化、温度升高及额外机械应力)均可能诱导蛋白质展开,进而促进蛋白质聚集物的形成。
因此,开发能够限制蛋白质展开和聚集的稳健配方对于确保蛋白质药物产品的质量至关重要。
聚山梨酯:防止蛋白质聚集的关键角色
为防止蛋白质聚集,常使用聚山梨酯类物质。这类非离子表面活性剂主要由山梨醇聚氧乙烯酯(POE)脂肪酸酯构成。 聚山梨酯在蛋白质制剂中的保护功能已得到充分研究,其主要通过两种机制发挥作用:(1) 作为蛋白质表面易聚集疏水位点的分子伴侣,维持其折叠结构;(2) 在界面处与蛋白质竞争结合位点,从而减少界面暴露。
聚山梨醇酯80(POE山梨醇单油酸酯,PS80)因能有效防止蛋白质吸附和聚集,成为商业化生物制剂配方中广泛使用的表面活性剂。然而存在一个关键问题:PS80的纯度和质量——尤其在产生机械应力的工艺过程中——会显著影响蛋白质稳定性,特别是IgG蛋白。
此外,聚山梨酯在低温下长期储存可能导致游离脂肪酸颗粒的形成,从而影响药物疗效。传统分析方法如光遮蔽法(LO)和流式成像法(FI)难以识别降解来源。随着时间推移,聚山梨酯易受宿主细胞蛋白(HCPs)的酶促水解作用,导致可见及亚可见颗粒的形成,进而损害药物的有效性。
由于聚山梨酯颗粒具有复杂的化学性质且在制剂环境中浓度极低,对其进行高通量、高灵敏度和高特异性的分析一直困难重重,这始终如同在干草堆里找针般棘手。
背景膜成像技术用于探索聚山梨醇酯80的功能特性
PS80对蛋白质稳定性的作用仍是争议话题。此外,部分降解的PS对蛋白质聚集的影响尚未被充分理解。这促使研究人员着手开展关于PS80功能性的研究。
在该研究中,将单克隆抗体(mAb)IgG置于三种不同的机械应力条件下,同时使用多药典(MC)级和中国药典(ChP)级PS80作为溶剂。通过在IgG制剂中添加部分水解的PS80,以探究其降解产物对蛋白质稳定性的影响。
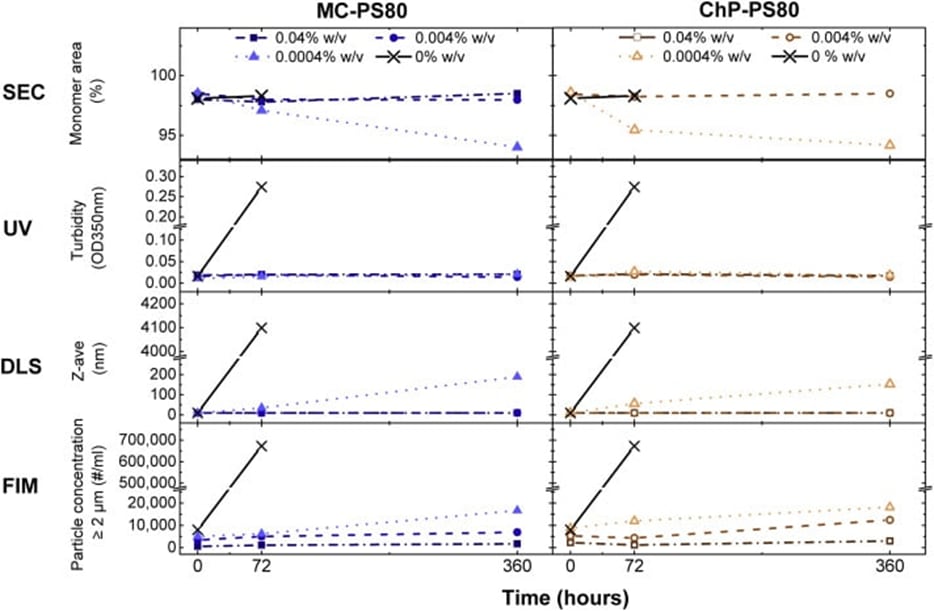
通过多种分析方法评估了PS80的功能性,这些方法包括:尺寸排阻色谱(SEC)、动态光散射(DLS)、流式成像显微镜(FIM)以及背景化膜成像(BMI),用于测量机械应力诱导的蛋白质聚集和颗粒形成。
研究人员使用了 Aura 用于微米级颗粒表征与定量的BMI系统。在层流条件下,将30μL样品转移至孔径为0.4μm的聚碳酸酯96孔膜滤板(Waters)上。 填充六个孔位后施加350毫巴真空,使液体流经滤膜并捕获颗粒。样品转移后,用90微升高纯水冲洗每个孔位以去除可溶性物质。每份样品均进行三重复测量。1
研究发现,在各项应力测试中,MC级与ChP级PS80的功能性并无显著差异。然而,随着PS80水解程度的增加,应力后测得的亚可见颗粒数量也随之升高。此外,在恒定PS80浓度下,更高水平的PS80降解产物可能导致IgG不稳定。研究人员得出结论:MC级与ChP级PS80具有同等保护作用,但PS80降解产物会损害IgG的稳定性。
基于Aura检测的高通量聚山梨酯颗粒鉴定
聚山梨酯的降解会产生三种独特的脂肪酸:月桂酸、肉豆蔻酸和棕榈酸。这些酸类形成的颗粒具有独特的形态特征,可通过Aura System的标记与成像功能精准定位。借助高亲和力染色剂BODIPY™ FLC16( 赛默飞世尔科技),研究人员能够准确识别游离脂肪酸(FFAs)。
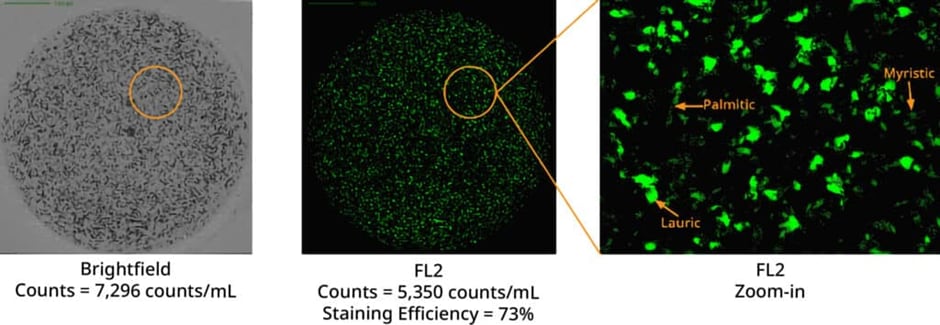
Aura System的聚山梨酯降解检测法简化了高浓度蛋白质制剂中降解辅料的检测流程。该方法具有高度适应性,可处理5微升至10毫升的广泛样本量,并能同时分析多达96个样本中的游离酸颗粒存在情况。这种高效性显著减少了时间和人力成本。
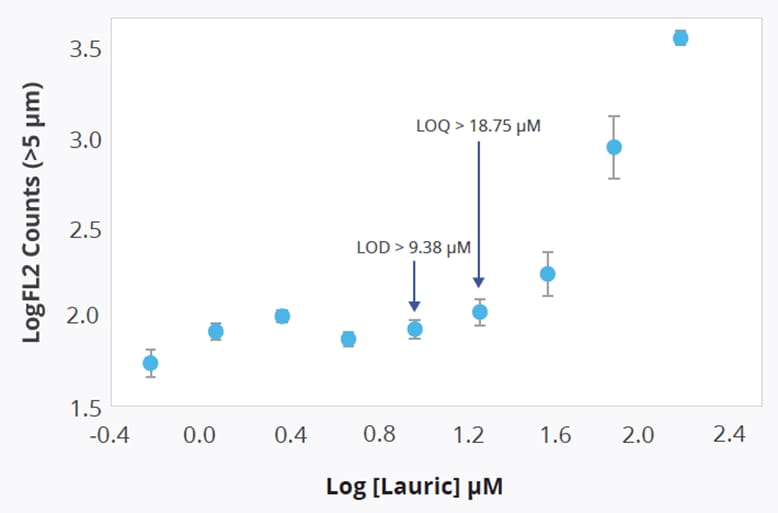
重要的是,Aura系统的聚山梨酯检测法具有足够的灵敏度,能够识别相对于月桂酸浓度超过9.38 µM(相当于2183计数值/毫升以上)的游离脂肪酸(FFAs),并可在浓度高于18.75 µM(即2976计数值/毫升以上)时对其进行定量分析。
总结
Aura 该系统简化了在药物生产流程任何阶段对蛋白质样本中降解组分的检测与鉴别。仅需5微升样本,该方法兼具特异性和灵敏度,能在数小时内完成96个样本的分析,显著超越其他检测技术。
此外,这项先进技术能够根据颗粒的形状、外观以及其独特的BODIPY FLC16标记,识别并区分聚山梨酯配方中的关键降解颗粒,使其成为不可或缺的工具。