是否该重新评估美国药典标准?探索Y型接头儿科药物给药兼容性
在复杂的儿科医疗领域中导航,尤其是在为儿童进行静脉注射(IV)给药时,会带来一系列独特的困难。当面对危重患者时,任务变得更加艰巨——这类患者常需大量静脉注射药物来维持体内稳态。
换个角度看,新生儿重症监护室的婴儿在单次住院期间平均接受8.5种静脉注射药物,而儿科重症监护室的儿童接受的静脉注射药物数量则高达惊人的49种。¹
由于儿科患者的特殊性,其药物配制与给药浓度通常与成人不同。这主要源于婴幼儿更高的营养需求。然而该过程存在潜在风险:不相容的静脉注射药物可能产生肉眼不可见的微粒。最新研究表明,接受多药静脉治疗的婴幼儿每日可能暴露于高达85,000个此类亚可见微粒。¹
这些颗粒对儿科患者的影响可能极为严重,可引发肺功能障碍、心血管骤停及多器官衰竭等危重并发症。此外,这些颗粒可能对免疫反应产生负面影响,形成额外风险。当联合使用未经物理相容性测试的药物时,意外给药这些颗粒的危险性将进一步增加。¹
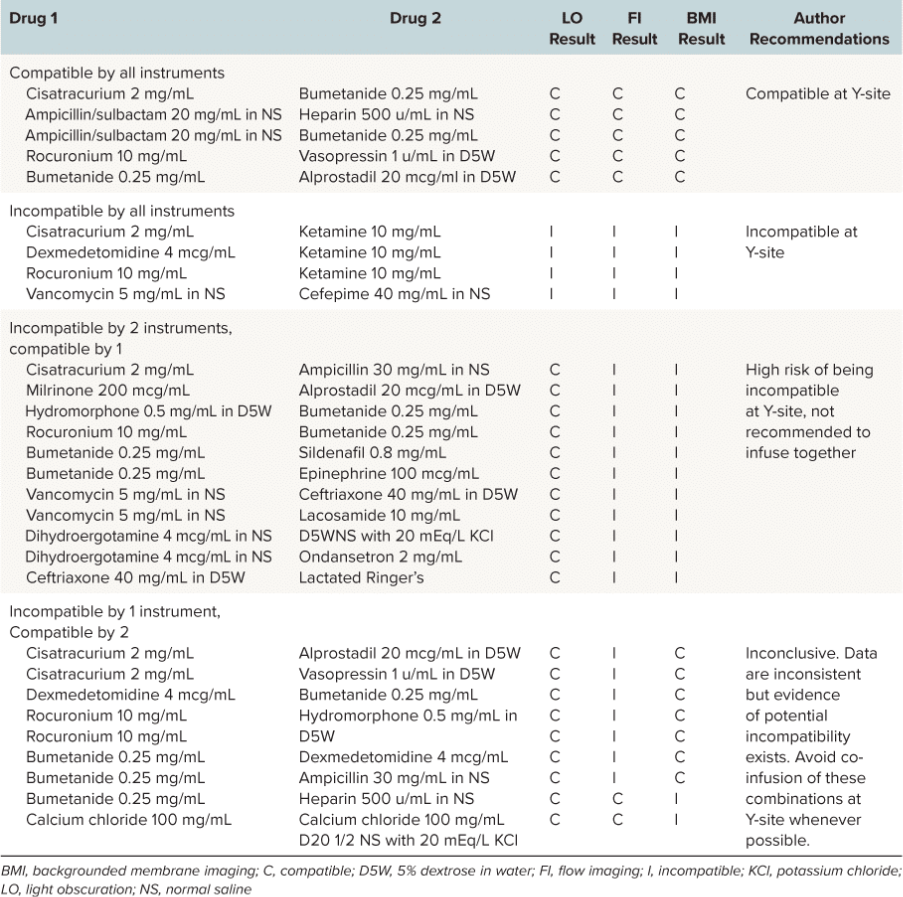
因此,研究人员着手评估29种药物组合在儿科常用浓度下的物理性静脉输液Y型接头兼容性,采用传统与创新技术并行。1 在一个 研究 发表于 《儿科药理学与治疗学杂志》亚可见 particle analysis 使用以下方法执行: 背景膜成像(BMI)一种高对比度成像技术,用于 奥拉系统凭借在两小时内完成96个样本检测的能力,它已成为药物研发领域的重要工具。
注射剂中颗粒物的理解
由于难以建立可靠的血管通路,儿科患者常需通过Y型接头同时接受多种静脉注射药物。然而这种做法可能引发药物相互作用及潜在的颗粒形成问题。这使医护人员陷入两难境地——要么在缺乏药物相容性数据的情况下冒险联合用药,要么面对建立额外血管通路带来的挑战。¹
鉴于儿科患者采用的输注速度较慢,静脉注射药物在进入血液循环前可能长时间相互作用。即使使用了在线过滤器,药物在过滤器下游仍可能发生显著混合,若药物存在物理不相容性,则可能导致颗粒形成。¹
美国药典(USP)所概述的注射剂中颗粒物评估传统方法包括光阻法(LO)和显微镜颗粒计数法。然而,新型技术如流式成像(FI)和生物体微观成像(BMI)能更精确地识别颗粒物,并更好地表征其形态特征。¹
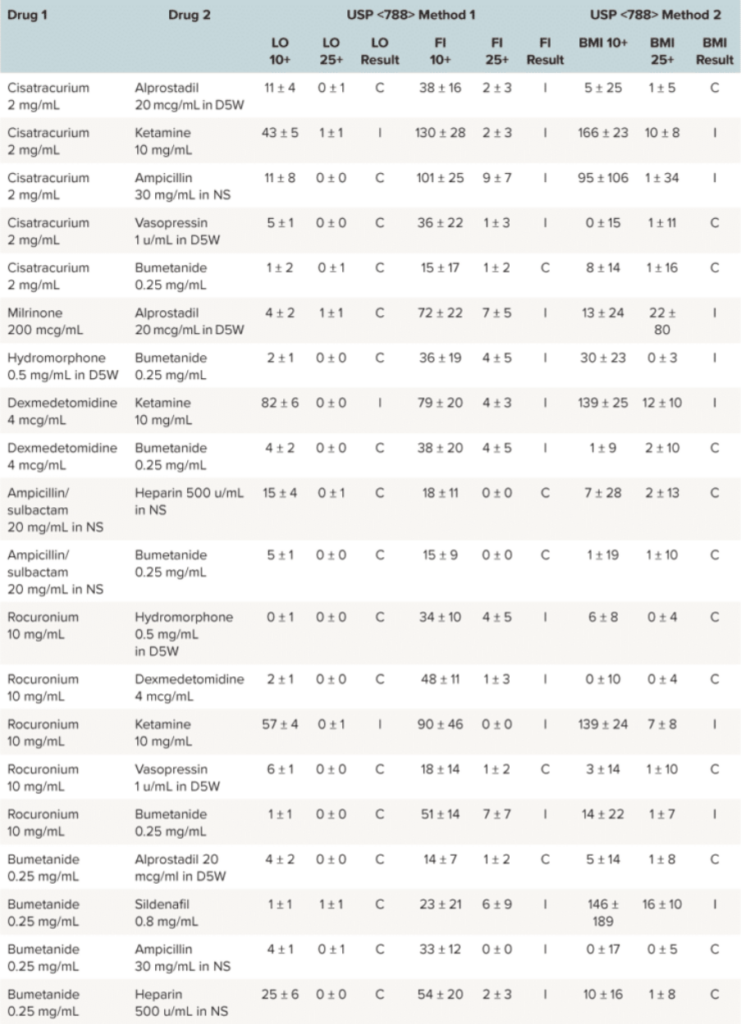
通过BMI实现亚可见粒子分析
Particles in high quantities or those with large diameters have the potential to be more devastating in small infants and children compared with adults, due to smaller pulmonary capillary size and relatively large fluid intake relative to their body weight. Because of the administration challenges specific to pediatric patients and the clinical risk associated with particle infusions, FI and BMI instrumental methodologies were used to assess USP <788> methods 1 and 2, despite a lack of precedent for either method in USP <788> guidelines. In this evaluation, these two methods demonstrated much higher accuracy for identifying particulates in solution when compared with LO.1
Applying USP <788> methods clinically to pediatric pharmacy practice brings to light clinical and analytical controversies. Are current LO and microscopy methods the most appropriate to use to test the compatibility of medication combinations? Additionally, are the current USP <788> particle count thresholds still applicable given the increased particle detection rates of instrumental methods now available? The USP chapter offers no explanation as to where the existing particle count thresholds originated, why method 1 has particle count limits that are essentially double that of method 2, or why large-volume parenterals are held to a different standard when compared with small-volume parenterals.1
然而,研究团队认为,无论采用何种方法得出的不相容性结果,都应禁止将该药物组合用于所有患者,特别是新生儿和婴幼儿。¹
总结
该研究发现,BMI等新型技术在识别微粒方面更为精准,这引发了当前《美国药典》指南在儿科药房实践中适用性的质疑。尽管这些发现标志着在改善临床结果和减少儿科患者静脉输液需求方面取得进展,但仍需进行进一步的化学相容性测试。1
参考文献
1. Ross, Emma L. 等. "Y型接头儿科药物输注的物理兼容性:对美国药典标准的质疑?" 《儿科药理学与治疗学杂志》,第28卷第1期,2023年,第84-92页,https://doi.org/10.5863/1551-6776-28.1.84。