Le projet de directive de la FDA d'octobre 2025 suscite l'engouement de l'industrie pour les biosimilaires
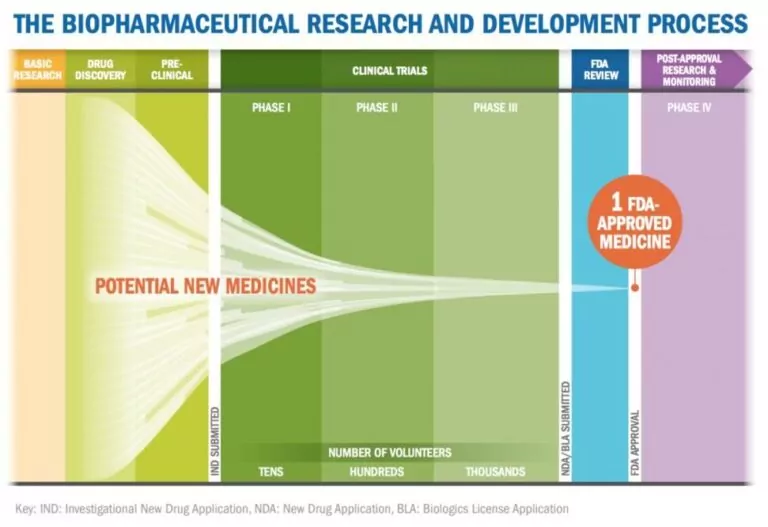
Le projet de directive de la FDA du 29 octobre 2025 a suscité beaucoup d'attention en raison de ses implications pour les développeurs et les patients. En permettant aux développeurs de contourner les études comparatives d'efficacité (CES) lorsque les analyses avancées sont des substituts efficaces, le projet de directive évite l'une des étapes les plus coûteuses, estimée à 70 % du développement total des biosimilaires....