El borrador de directrices de la FDA para octubre de 2025 despierta el interés de la industria por los biosimilares
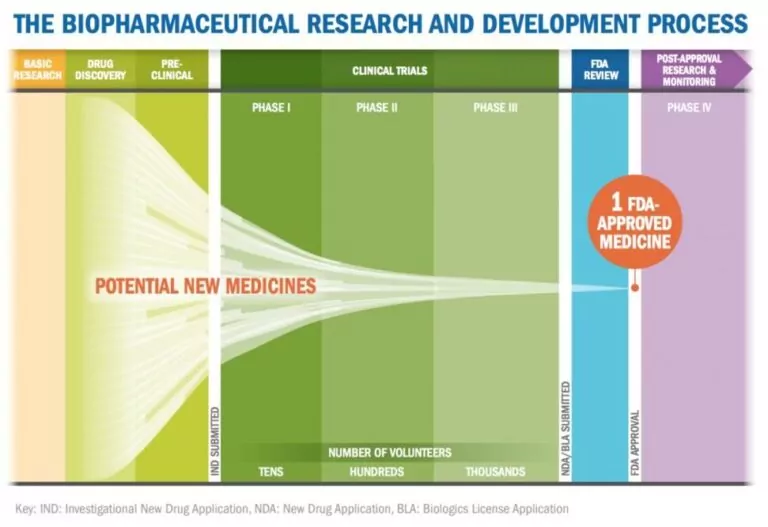
El borrador de la guía de la FDA del 29 de octubre de 2025 ha generado una atención significativa debido a las implicaciones tanto para los desarrolladores como para los pacientes. Al permitir a los desarrolladores eludir los estudios comparativos de eficacia (CES) cuando los análisis avanzados son sustitutos satisfactorios, el proyecto de directrices evita uno de los pasos más costosos, que se estima representa el 70% del desarrollo total de biosimilares....